
已知Zn(s)+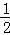 O2(g)═ZnO(s)△H=﹣350kJ/mol,则1g Zn在氧气中燃烧放出的热量约为()
O2(g)═ZnO(s)△H=﹣350kJ/mol,则1g Zn在氧气中燃烧放出的热量约为()
A. 5.4 kJ B. 350 kJ C. 3.5 kJ D. 8.5 kJ
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是()

A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于丙烯(CH3﹣CH=CH2)的说法正确的( )
A. 丙烯分子有8个σ键,1个π键
B. 丙烯分子中3个碳原子都是sp3杂化
C. 丙烯分子不存在非极性键
D. 丙烯分子中3个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是某课题组设计的由烃A合成聚酯类高分子材料.
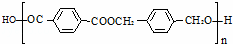 的路线:
的路线:
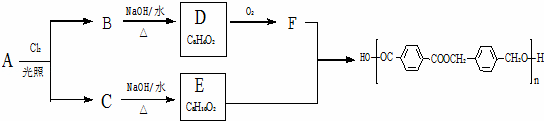
已知同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮.
根据以上信息回答:
(1)A的分子式 ,F中官能团的名称是 .
(2)化合物D的结构简式是 ,由B生成D的反应过程中生成的不稳定中间体的结构简式是 ,该中间体生成D的反应类型为 .
(3)E与F反应的化学方程式是 ,反应类型为 .与E具有相同官能团的含苯环的同分异构体有(写结构简式) 、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)=2H2(g)+O2(g);△H1=+571.6kJ/mol,
2H2(g)+O2(g)=2H2O(g);△H2=﹣483.6kJ/mol.
当1g 液态水变成气态水时,对其热量变化的下列描述:
①放出;②吸收;③2.44kJ;④4.88kJ;⑤88kJ,
其中正确的是()
A. ②和⑤ B. ①和③ C. ②和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的.”利用盖斯定律可测某些特别反应的热效应.
(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=﹣2983.2kJ/mol
(2)P(s,红磷)+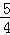 O2(g)=
O2(g)=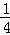 P4O10(s)△H2=﹣738.5kJ/mol
P4O10(s)△H2=﹣738.5kJ/mol
则白磷转化为红磷的热化学方程式 .相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L﹣1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是()
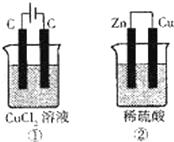
A. 产生气体的体积:①>②
B. 两极上析出物质的质量:①>②
C. 溶液的pH变化:①增大,②减小
D. 电极反应式:①中阳极:4OH﹣﹣→2H2O+O2↑+4e﹣;②中阴极:2H++2e﹣﹣→H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com