
②又知SOCl2极易和水发生反应:SOCl2+H2O===SO2+2HCl,实验室制取无水ZnCl2是采用将ZnCl2·XH2O与SOCl2混合加热的方法制取无水ZnCl2。
SOCl2的作用为___________。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)生产氯化锌的主要原料有锌渣等,这些物料含锌30%-70%(其中含有少量的Fe、Cu等硫酸盐),生产工艺流程如图所示(第一次净化含调节pH的过程)。www.ks5.u.com
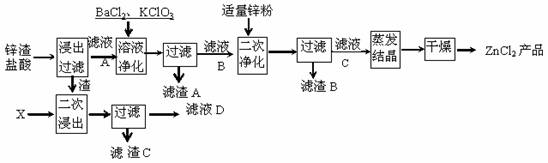
(1)二次浸出时加入的X的化学式是______________,滤液D应该和滤液A、B、C中的滤液 合并。
(2)第一次净化时加入BaCl2的作用是 。
(3)二次净化后过滤得到的滤渣B的主要成分是 。
(4)请用离子方程式表示加入氯酸钾的作用 。
(5)已知SOCl2是液态化合物,沸点是77℃,在盛有10mL水的锥形瓶中小心滴加几滴SOCl2,可观察到反应剧烈,液面上有白雾形成,并逸出刺激性气味的气体。工业上常用ZnCl2?3H2O和SOCl2混合共热来制取无水氯化锌,这种制法可行性的原因是
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(十二)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com