
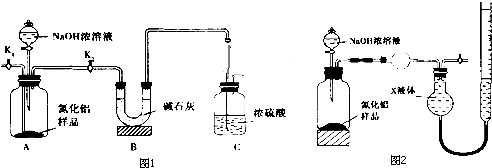

分析 (1)氨气是和浓硫酸能发生反应的气体,易发生倒吸;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
(4)根据元素守恒可知,氮化铝与NaOH溶液反应生成氨气和偏铝酸钠;
(5)氨气极易溶于水,量气装置中的X液体不能与氨气反应,不能使氨气溶解;
(6)依据AIN+NaOH+H2O═NaAIO2+NH3↑在定量关系计算.
解答 解:(1)氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:防止倒吸;
(2)组装好实验装置,需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后卫把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性;把装置中残留的氨气全部赶入C装置;
(3)装置存在缺陷是空气中的水蒸气和二氧化碳也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管,
故答案为:C装置出口处连接一个干燥装置;
(4)根据元素守恒可知,氮化铝与NaOH溶液反应生成氨气和偏铝酸钠,反应的离子方程式为AlN+OH-+H2O=AlO2-+NH3↑,
故答案为:AlN+OH-+H2O=AlO2-+NH3↑;
(5)a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液,测定氨气的体积,故d正确;
故答案为:ad;
(6)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),
AlN+NaOH+H2O═NaAIO2+NH3↑
41 22.4L
m V×10-3L
m=$\frac{41V×10{\;}^{-3}}{22.4}$g,则AlN的质量分数=$\frac{41V×10{\;}^{-3}}{22.4m}$×100%=$\frac{41V×10{\;}^{-3}}{22.4m}$×100%,
故答案为:$\frac{41V×10{\;}^{-3}}{22.4m}$×100%.
点评 本题考查了物质含量的测定探究实验设计和实验分析判断,把握实验基本操作和物质性质是解题关键,题目难度中等,注意把握实验原理以及各部操作的目的,侧重于考查学生的实验能力和计算能力.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl-、NO3-、Fe3+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向以上平衡体系中加入足量浓NaOH溶液,两平衡都向右移动,Al(OH)3的质量增加 | |
| B. | 向以上平衡体系中加入足量浓盐酸,Al3+的物质的量增加 | |
| C. | 在同一溶液中,Al3+与OH-能大量共存 | |
| D. | 在同一溶液中,AlO2-与H+能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥的蓝色布条 | B. | 用干燥的蓝色石蕊试纸 | ||
| C. | 将气体通人硝酸银溶液中 | D. | 用湿润的碘化钾淀粉试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | X氢化物的沸点高于Z氢化物的沸点 | |
| C. | 最高价氧化物对应水化物的酸性X大于Z | |
| D. | 室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+Cu2+═Fe2++Cu | |
| B. | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Cl2+H2O═H++Cl-+HClO | |
| D. | CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 用醋检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 将铁屑加入Cu2+溶液中:Fe+Cu2+═Fe2++Cu | |
| D. | 将铝片放入过量NaOH溶液中2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com