

| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
| Ksp | 8.0×10-16 | 2.2×10-22 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
| c(NH4+)?c(Cl-) |
| c(NH3?H2O) |
| 10-3×10-3 |
| 0.1 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
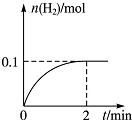 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
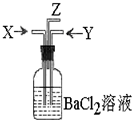 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )| A、洗气瓶中产生的沉淀是碳酸钡 |
| B、Z导管出来的气体中含有二氧化碳 |
| C、气瓶中产生的沉淀是硫酸钡 |
| D、Z导管口有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | AgNO3 | Ba(OH)2 | AgCl | BaCl2 |
| 水中 | 216 | 9.02 | 35.8 | |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| A、2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2 |
| B、2AgNO3+BaCl2=2AgCl+Ba(NO3)2↓ |
| C、2AgCl+Ba(NO3)2=2AgNO3↓+BaCl2 |
| D、2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
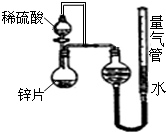 某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.
某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.| 序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 10 | 1 | t1 |
| Ⅱ | 10 | 3 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n |
| B、一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积 |
| C、某气态烃CxHy与足量O2恰好完全反应(温度>100℃),如果反应前后气体体积不变,则y=4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4Fe(OH)2+2H2O+O2═4Fe(OH)3 |
| B、2Fe+2H2O+O2═2Fe(OH)2 |
| C、正极反应:2H2O+O2+4 e-→4OH- |
| D、负极反应:Fe→Fe3++3 e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com