
【题目】研究表明许多疾病,包括基因突变(癌变、动脉硬化等)和生物机体中毒等,可能是一氧化氮的释放或调节不正常引起的。用间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过),下列相关判断不正确的是 ( )
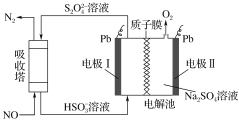
A.电极Ⅰ接电源负极,电极反应式为2HSO3-+2H++2e-==S2O42-+2H2O
B.质子从电极Ⅱ通过质子膜向电极Ⅰ作定向移动
C.吸收塔中的反应为2NO+2S2O42-+2H2O==N2+4HSO3-
D.每处理2 mol NO,电解池质量减少32 g
【答案】D
【解析】
从图中可以看出,电极Ⅱ中H2O失去电子生成O2和H+;电极Ⅰ得到电子,将HSO3-转化为S2O42-。
A.在电极Ⅰ上HSO3-获得电子生成S2O42-,则电极Ⅰ为阴极,接电源负极,电极反应式为2HSO3-+2H++2e-==S2O42-+2H2O,A正确;
B.电解池中质子从电极Ⅱ(阳极)向电极Ⅰ(阴极)作定向移动,故B正确;
C.吸收塔中的S2O42-与NO反应生成N2与HSO3-,反应的离子方程式为2NO+2S2O42-+2H2O==N2+4HSO3-,C正确;
D.电解池中发生的反应为4HSO3-==2H2O+O2↑+2S2O42-,吸收塔中的反应为2NO+2S2O42-+2H2O==N2+4HSO3-,结合题图可知,每处理1 mol NO,电解池中分解2 mol HSO3-,HSO3-分解生成的O2逸出,S2O42-进入吸收塔中,故电解池的质量会增加1 mol H2O的质量,即18 g,所以每处理2 mol NO,电解池质量增加36 g,D不正确;
故选D。


科目:高中化学 来源: 题型:
【题目】普通干电池是一种广泛使用的可移动化学电源。 某同学在探究废酸性干电池内物质回收利用时,进行如图所示实验:
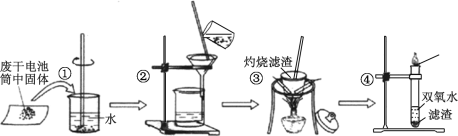
请回答以下问题:
(1)干电池工作时正极电极反应式为:2NH4++2e- = 2NH3↑+H2↑,则负极电极反应式是___________。 电池中加入 MnO2 的作用是除去正极上的某产物, 本身生成Mn2O3,该反应的化学方程式是_______________。
(2)步骤③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______ 、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有_____。
(3)向步骤④的试管中加入步骤③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_____。
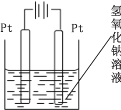
(4)查询资料得知,通过电解可将 Mn2O3 转化为 MnO2。 为此某同学设计了如图所示装置,并将混合物粉末调成糊状,附在其中的_________(填“左”或“右”)边电极上,该电极上发生反应的电极反应式是_____, 在电解过程中溶液的 pH 将__________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10min内,相同浓度的有机污染物X的降解率随pH和温度的关系如图1和图2所示。
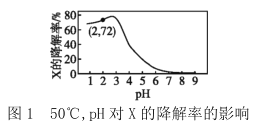
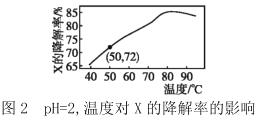
下列说法不正确的是( )
A.50℃,pH=4时X降解速率大于pH=5时的降解速率
B.由图1和图2可知,随温度的升高和pH的增大X的降解率不一定增大
C.由图1和图2可判断反应最佳条件:pH=3,温度为80℃
D.若50℃,pH=2时降解速率v(X)=1.44×10-4mol·L-1·min-1,则初始c(X)=2.0×10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________
4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________![]() 填字母代号
填字母代号![]() 。
。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2V逆(NO2)=V正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
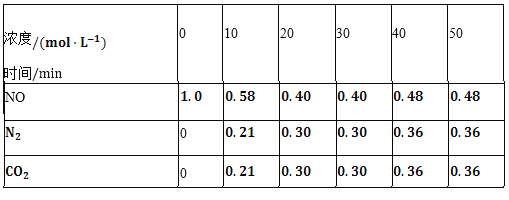
①根据表中数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)________;计算该反应的平衡常数![]() ________。
________。
②根据上表数据判断,由30min到40min时改变的条件可能是________![]() 任写一种
任写一种![]() 。
。
③若30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,此时NO的转化率________![]() 填“升高”或“降低”
填“升高”或“降低”![]() ,△H________
,△H________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。(3)以
。(3)以![]() 与
与![]() 为原料可合成化肥尿素化学式为
为原料可合成化肥尿素化学式为![]() 。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙醇合成部分有机物的路线如下:
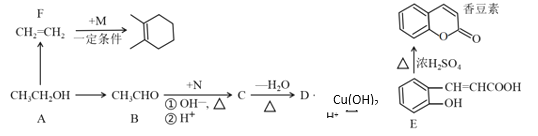
已知:CH3CHO+CH3CHO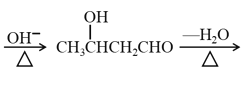 CH3CH=CHCHO
CH3CH=CHCHO
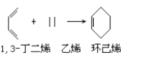
(1)香豆素所含官能团名称_____________。
(2)M的名称_________。
(3)N的结构简式____________。
(4)B与银氨溶液反应方程式___________________。
(5)香豆素在NaOH溶液中发生水解反应的化学方程式为_____________。
(6)由A到F反应的化学方程式___________。
(7)以乙醇为起始原料,无机试剂任选,合成CH3CH=CHCOOC2H5写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
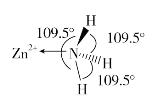
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
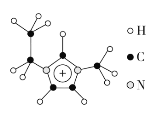
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
(5)Zn与S形成某种化合物的晶胞如图所示。
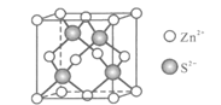
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
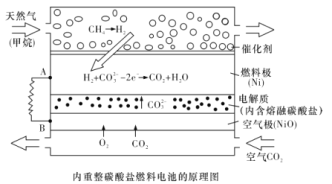
A.以此电池为电源电解饱和食盐水,当有0.2 mol e-转移时,阳极产生2.24 L气体
B.若以甲烷为燃料气时负极电极反应式:CH4+5O2- - 8e - =CO32- +2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为O2+4e- +2CO2 =2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.NH4Cl+NaOH ![]() NH3↑+NaCl+H2O
NH3↑+NaCl+H2O
B.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Na2O2+2H2O=2NaOH+H2O2
D.SO2+H2O=H2SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com