
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
分析 (1)反应热=反应物总键能-生成物总键能;
(2)化学平衡常数只受温度影响,根据温度对平衡移动的影响,进而判断温度对平衡常数影响;
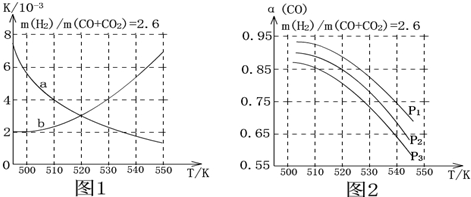
(3)由图可知,压强一定时,随温度的升高,CO的转化率降低,根据升高温度对反应①、③的影响,进行分析CO转化率变化原因;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子式减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大.
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1,故答案为:-99;
(2)反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
故答案为:a;反应①正反应为放热反应,平衡常数随温度升高而减小;
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P1>P2>P3,
故答案为:减小;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
P1>P2>P3;相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高.
点评 本题考查反应热有关计算、平衡常数及其影响因素、化学平衡的影响因素、化学平衡图象综合应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的导电性一定比弱电解质的导电性强 | |
| B. | 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱 | |
| C. | 金属元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子得电子多时氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )| A. | 分子式是C18H26O2 | |
| B. | 能发生银镜反应 | |
| C. | 既能发生加成反应,也能发生酯化反应 | |
| D. | 既能发生氧化反应,也能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中和盐酸:CO${\;}_{{3}_{\;}}$2-+2H+=H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O | |
| C. | 向碳酸氢铵溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用MnS除去MnCl2溶液中的Cu2+:MnS+Cu2+=CuS+Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c mol/L | B. | 3c mol/L | C. | $\frac{3c{V}_{1}}{{V}_{2}}$mol/L | D. | $\frac{c{V}_{1}}{{V}_{2}}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
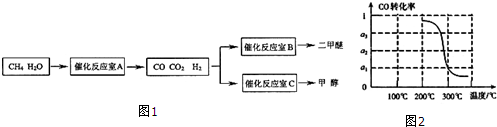
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com