
| A. | 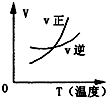 | B. | 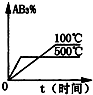 | C. | 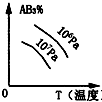 | D. |  |
分析 该反应吸热反应,升高温度,反应速率增大,平衡正向移动,AB3的含量减小;且该反应为气体体积增大的反应,增大压强,平衡逆向移动,AB3的含量增大,结合图象来解答.
解答 解:A.该反应吸热反应,升高温度,平衡正向移动,图中交叉点后正反应速率大于逆反应速率,故A正确;
B.温度高,反应速率快,且温度高平衡正向移动,AB3的含量减小,与图象一致,故B正确;
C.温度高平衡正向移动,AB3的含量减小,压强大时平衡逆向移动,AB3的含量增大,与图象不符,故C错误;
D.温度高平衡正向移动,AB3的含量减小,压强大时平衡逆向移动,AB3的含量增大,与图象一致,故D正确;
故选C.
点评 本题考查化学平衡的移动及图象,为高频考点,把握图象中纵横坐标及温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 ;
;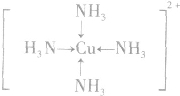 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度℃ | 10 | 30 | 60 | 90 |
| 浓度(mol/L) | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
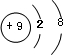 ,该元素与金属性最强的元素形成的化合物的电子式为
,该元素与金属性最强的元素形成的化合物的电子式为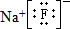 ;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).
;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:| A | B | |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| … | E | A | B | ||
| C | … | D |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四项 | B. | 三项 | C. | 二项 | D. | 一项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com