
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)22 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液(FeCl2):通入适量Cl2 | |
| B. | Fe2O3固体(Al2O3):加入烧碱溶液,过滤 | |
| C. | Cl2气体(HCl):通过NaOH溶液洗气后干燥 | |
| D. | Na2CO3固体(NaHCO3):加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
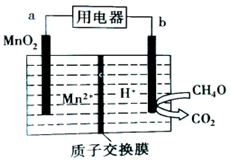
| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应为CH4O-6e-+H2O=CO2+6H+ | |
| C. | 电子从b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧移向右侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
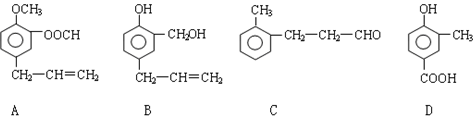
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
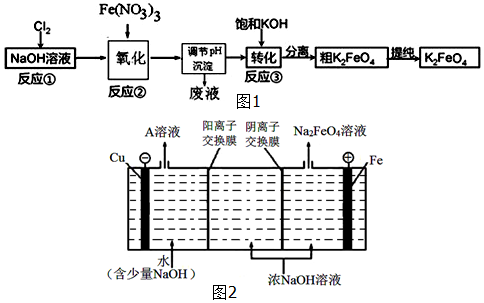
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 氯化镁溶液中加入氢氧化钠溶液:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铝片放入过量浓NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将铜片放入过量稀HNO3溶液中:3Cu+8HNO3═3Cu2++6NO3-+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠粒投入100mL稀盐酸中,溶液质量减轻 | |
| B. | 加热氧化钠和过氧化钠固体混合物,固体质量减轻 | |
| C. | 铁钉放入氯化铜溶液中,固体质量增大 | |
| D. | 光照新制氯水,溶液的颜色变浅,酸性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com