
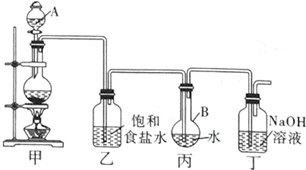
分析 (1)装置甲中发生反应为实验室制取氯气的反应;带有活塞或旋塞的仪器要检查是否漏水;
(2)①氯气为黄绿色气体,氯水为黄绿色,根据饱和溶液中不能溶解氯气来解答;
②因次氯酸具有氧化性,不能用PH测量氯水的PH,直接用PH计;
③浓盐酸易挥发,制得的氯气中含有氯化氢,氯化氢溶于水,溶液酸性增强;
(3)在饱和氯水中存在如下平衡:Cl2+H2O?HClO+HCl,盐酸的酸性比碳酸强,而HClO的酸性比碳酸弱,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO,同时生成Ca(HCO3)2和CaCl2,根据Ca(HCO3)2的性质进行判断.
解答 解:(1)装置甲中浓硫酸和二氧化锰反应制取氯气,反应的方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,带有活塞或旋塞的仪器要检查是否漏水,则装置甲中的分液漏斗应检漏,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;分液漏斗;
(2)①因饱和溶液中不能溶解氯气以及氯气为黄绿色,所以丙中液体呈黄绿色,丙中的导管有气泡溢出水面,有黄绿色气体进入丁中,且液面上方充满黄绿色气体即可证明氯水已饱和,
故答案为:丙中液体呈黄绿色,且液面上方充满黄绿色气体,有黄绿色气体进入丁中;
②由于饱和氯水中含有氧化性的次氯酸,会将PH试纸氧化,因此不能用PH试纸测定溶液的PH,直接用PH计测量,
故答案为:直接用PH计测量;
③浓盐酸易挥发,氯气中含有氯化氢,若撤去装置乙,直接将装置甲和丙相连.氯化氢溶于水,溶液酸性增强,使测定的pH减小,
故答案为:使测定的pH减小;
(3)①在饱和氯水中存在如下平衡:Cl2+H2O?HClO+HCl,盐酸的酸性比碳酸强,而HClO的酸性比碳酸弱,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO,
故答案为:在饱和氯水中存在如下平衡:Cl2+H2O?HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO;
②由实验将滤液滴在有色布条上,发现其漂白性更强可知,除了溶解的极少量氯气外,还含有HClO,过量的CaCO3与溶液中的HCl发生反应,还生成Ca(HCO3)2和CaCl2,
故答案为:HClO、Ca(HCO3)2、CaCl2;
③将滤液的第一份与石灰水混合,立即产生大量白色沉淀CaC03,反应的离子方程式为Ca2++HCO3-+OH-=CaC03↓+H2O,
故答案为:Ca2++HCO3-+OH-=CaC03↓+H2O.
点评 本题考查律氯气的性质以及氯水的性质,题目难度中等,本题注意过量碳酸钙与氯水反应的原理,此为解答该题的关键,本题易错点为(3)过量的CaCO3与饱和氯水反应生成Ca(HCO3)2.


科目:高中化学 来源: 题型:选择题
| A. | 分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢 | |
| B. | 分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少 | |
| C. | 分别配成溶液,加入澄清石灰水,比较是否有沉淀生成 | |
| D. | 分别将等质量的白色粉末加热,将产生的气体通入澄清石灰水中看是否变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘升华时需要克服分子间作用力,不破坏共价键 | |
| B. | NaCl和HCl溶于水都电离出Cl-,故它们都存在离子键 | |
| C. | 干冰和水分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物在任何状态下都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2 和 D2 互为同位素 | |
| B. | CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体 | |
| C. | 甲苯和 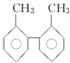 互为同系物 互为同系物 | |
| D. | 金刚石、石墨和“足球烯”(分子式为 C60)为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
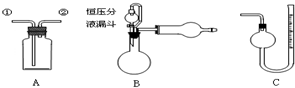
| A. | 装置A从①进气,用排水法可收集NO气体 | |
| B. | 装置A中盛饱和Na2CO3溶液,从①进气除去CO2中混有的HCl | |
| C. | 装置A、B组合,从A中①进气可制备、收集干燥纯净的NH3 | |
| D. | 装置B、C组合,可测定一定质量样品中Zn的氧化程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com