
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 44∶2∶28
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是( )
A. 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异构体
B. 1 mol羟基(-OH)所含的电子数约为10×6.02×1023
C. 14g分子式为CnH2n的链烃中含有的C=C的数目一定为1/nNA
D. ![]() 是戊烷的球棍模型
是戊烷的球棍模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,下列说法不正确的是

A. 若它们均为金属元素,则Y的氧化物可能含有共价键
B. 若Z的核电荷数是X的2倍,则ZX2为大气污染物
C. 若Y的最外层电子数等于其周期序数,则Z可为半导体材料
D. 若X、Z均为非金属元素,则形成酸的酸性X一定强于Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:

(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______.
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”) .
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示).
(4)Na在Y2中燃烧产物的电子式为________________.
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体.
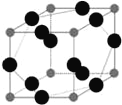
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
熔点/ ℃ | 16.6 | -89.5 | -73.5 |
沸点/ ℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
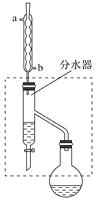
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若绍兴全市的100余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨。甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2CH3OH 。
请根据图示回答下列:
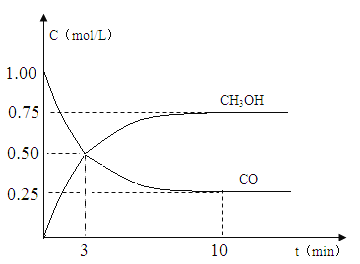
(1)关于该自发反应的下列说法中,正确的是 (填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,CO的平均反应速率v(CO)= mol/(Lmin),该反应的平衡常数K= 。
(3)恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO)增大的有 。
A.升高温度 B.充入He气 C.再冲入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量= g/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图:

已知:①有关金属离子生成氢氧化物沉淀所需的pH如图。

②25℃时,NH3·H2O的电离常数Kb=1.8×10-5。
HF的电离常数Ka=7.2×10-4,Ksp (MgF2)=7.4×10-11。
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是__________(填化学式)。
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理解释(用必要的文
字和离子方程式回答)_______________________________________。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=________ mol·L-1(列出计算式即可)。
NH4F溶液呈 _____(填“酸性”、“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=_______ mol·L-1。
(5)在NaOH溶液中用NaClO与NiSO4反应可得NiO(OH),化学方程式为________________________________;NiO(OH)与贮氢的镧镍合金可组成镍氢碱性电池(KOH溶液),工作原理为:LaNi5H6+6NiO(OH) ![]() LaNi5+6NiO+6H2O,负极的电极反应式:__________________________________。
LaNi5+6NiO+6H2O,负极的电极反应式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com