
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
B. 0.1mol H2 和0.1molI2 于密闭容器中充分反应后,其分子总数为0.2NA
C. 常温下,1L pH=1的H2SO4溶液中的H+数目为0.2NA
D. 标准状况下,2.24 L苯所含分子数为0.1NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如下图所示.已知海水中含Na+、Cl﹣、Ca2+、Mg2+、SO ![]() 等离子,电极为惰性电极.下列叙述中正确的是( )
等离子,电极为惰性电极.下列叙述中正确的是( ) 
A.A膜是阳离子交换膜
B.通电后,海水中阴离子往b电极处运动
C.通电后,b电极上产生无色气体,溶液中出现白色沉淀
D.通电后,a电极的电极反应式为4OH﹣﹣4e﹣═O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝及其化合物在生产生活中具有重要的应用.回答下列问题:
(1)工业上冶炼金属镁是采用惰性电极电解熔融MgCl2的方法,此时阴极的电极反应式为:;
(2)除去MgCl2溶液中的Fe2+ , 常加入少量H2O2 , 使Fe2+氧化为Fe3+ , 然后加入少量碱性物质至溶液pH=4,此时c(Fe3+)=mol/L[已知Fe(OH)3的Ksp=4×10﹣38]
(3)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,关于为什么不采用电解熔融AlCl3的方法的叙述正确的是(选择填空):
A.AlCl3是非电解质
B.AlCl3水溶液不导电
C.AlCl3是共价化合物
D.AlCl3熔点太高
(4)用碳棒做电极电解熔融Al2O3时,阳极需要定期更换,其原因是(用电极反应式和化学方程式回答);
(5)已知:Al2O3(熔融,l)=2Al(s)+ ![]() O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
(6)明矾的化学式为KAl(SO4)212H2O,它可以作为净水剂,用离子方程式表示其能够净水的原因;向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH7(填>、<、=);
(7)若在空气中加热固体MgCl26H2O,可水解生成Mg(OH)Cl,写出相关的化学方程式 , 所以,为了抑制MgCl26H2O在加热时水解,可在干燥的气流中加热,可得到无水氯化镁.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题:
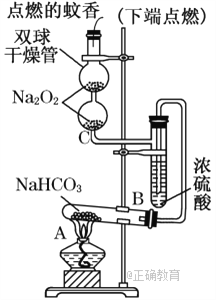
(1)在A试管内发生反应的化学方程式是____________________________________.
(2)B装置的作用是_______________________________________________________.
(3)在双球干燥管内发生反应的化学方程式为___________________________________.
(4)双球干燥管内观察到的实验现象是_________________________________________.上述实验现象说明________________________________________________________.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
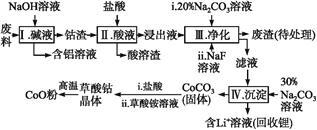
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是__________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______。
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210 ℃时,固体质量减轻的原因是__________。
②经测定,加热到210~290 ℃过程中的生成物只有CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年春季抗击新冠肺炎中N95口罩成为“明星”,丙烯是制造N95口罩的原料。下列有关丙烯的说法错误的是( )
A.丙烯和乙烯互为同系物
B.丙烯能使酸性高锰酸钾溶液褪色
C.丙烯分子中碳原子在一条直线上
D.丙烯与氢气的加成产物是饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应中,分别表示正极反应和负极反应的是
①Br2+2e-=2Br- ②2Br--2e-=Br2
③Zn-2e-=Zn2+ ④Zn2++2e-=Zn
A.②和③B.②和①
C.①和③D.④和①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下).将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为多少mL。
A.168B.224C.336D.504
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:
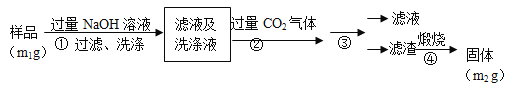
(4)步骤②生成沉淀的离子方程式为_________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com