
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
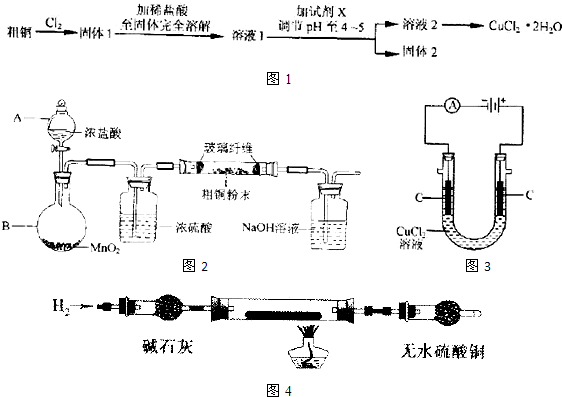
| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:必修一导学指导化学苏教版 苏教版 题型:013
|
某白色晶体X与浓硫酸共热有气体Y放出,与浓氢氧化钠溶液共热有气体Z放出,Y、Z相遇又生成X,则X是 | |
| [ ] | |
A. |
Na2CO3 |
B. |
NH4HCO3 |
C. |
NH4Cl |
D. |
NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。

(1)写出试管B中的实验现象____________________________________。
(2)写出A中反应的化学方程式:___________________________。
(3)充分反应后,若A试管中有铜片剩余,继续向A中加入H2O2,发现铜片溶解,反应的离子方程式为__________。
(4)充分反应后,若A试管中无铜片剩余,但出现白色混浊,该白色固体是________,初步确认该白色固体是什么物质的实验操作方法是__________________。
(5)B试管口的棉花应沾有的试剂是____________________________________。
(6)小组成员向(3)反应后的溶液中加入足量的氧化铜。使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却后结晶制得硫酸铜晶体(CuSO4?xH2O)。小组成员采用加热法测定该晶体里结晶水x的值
①在他们的实验操作中,至少称量四次,最后两次称量的目的是
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.0g | 37.8g | 27.0g |
根据上表数据计算判断x的实测值比理论值(x=5)____________(填“偏大”、“偏小”),这次实验中产生误差的原因可能是__________(填序号)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
(1)写出试管B中的实验现象 。
(2)写出A中反应的化学方程式: 。
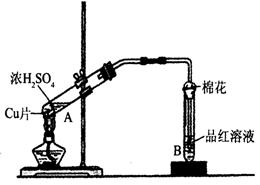 (3)充分反应后,若A试管中有铜片剩余,继续向A中加入
(3)充分反应后,若A试管中有铜片剩余,继续向A中加入
NaNO3,发现铜片溶解,反应的离子方程式
为 。
(4)充分反应后,若A试管中无铜片剩余,
但出现白色混浊,该白色固体是 ,
初步确认该白色固体是什么物质的实验操作方法
是 。
(5)B试管口的棉花应沾有的试剂是 。
(6)小组成员向(4)反应后的溶液中加入足量的氧化铜。使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却后结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值
①在他们的实验操作中,至少称量四次,最后两次称量的目的是
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.0g | 37.8g | 27.0g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”、“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com