
【题目】下列说法不正确 的是( )
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
B.蔗糖、淀粉、油脂及其水解产物均为非电解质
C.通过红外光谱分析可以区分乙醇与乙酸乙酯
D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】化学与人们的“衣食住行“,休戚相关.
(1)①材料是人类赖以生存的重要物质基础.合金是被广泛应用的金属材料.钢属于(填“铁合金”或“铝合金”);铁锈蚀主要发生的是电化学腐蚀,其负极反应式为;无机非金属材料包括玻璃、水泥和 . ②真丝织品与化纤织品是生活中最常用的面料,下列有关说法不正确的是 .
A.真丝织品中主要含有C,H,O,N四种元素
B.可以用燃烧的方法来区分
C.化纤织品中成分遇到重金属盐,强酸,强碱,有机物等会产生沉淀而失去活性
D.两种产品都属于高分子材料
(2)①我国居民一般尿液偏酸性,平时饮食中应多吃(填”肉类”,”几鸡蛋”,”水果”)等碱性食物;微量元素与人体健康密切相关,为了预防碘缺乏,启动了”食盐加碘”,就是在食盐中加适量的 . 如治疗缺铁性贫血可服用”亚铁丸”(内含有FeSO4 , 外面裹了一层糖衣),试设计实验判断该亚铁丸是否质 . ②服药时要对症下药,胃舒平(主要成分Al(OH)3)适用于治疗(填”感冒发热”,”细菌感染”,”胃酸过多”).解热镇痛药阿司匹林的结构式为 ![]()
请你写出其中含有的一个官能团的名称 .
(3)①汽车尾气(主要有NO等物质)是城市的污染源.治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂.钯合金作催化剂).它的特点是使CO与NO反应,生成无毒气体.写出CO与NO反应的化学方程式: . ②获得洁净安全的饮用水是每个人的正常需要.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉进行杀菌消毒,其原理可用化学方程式表示为
③奥运期间使用了全生物降解塑料袋,用于餐饮和处理垃圾,而不用传统的高分子材料聚乙烯、聚氯乙烯及聚苯乙烯等,这是为了防止(填写环境术语).“鸟巢”体育场内,各区座位席的通道口设有专门垃圾箱,箱体上分别用绿色和黑色字样标有“可回收物”和“其他垃圾”,如图图标表示 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的四个原电池装置,其中结论正确的是( ) 
A.①中Mg作负极,电子流向:Mg→稀硫酸→Al
B.②中Al作负极,OH迁移方向:Al→外电路→Mg
C.③中Fe作正极,电极反应式:2H++2e═H2↑
D.④中Cu作正极,电极反应式:O2+4e+2H2O═4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,能大量共存的离子组是
A. Mg2+、Na+、SO42-、Cl- B. Al3+、Ag+、NO3-、Cl-
C. Cu2+、Cl-、NO3-、OH- D. K+、H+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
(1)基态Fe3+的核外电子排布式为 . C、N、O三种元素的第一电离能由大到小的顺序是;
(2)尿素分子中C、N原子的杂化方式分别是 .
(3)[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 , 与NO3﹣互为等电子体的一种化合物是(写化学式).
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示.
①铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 .
②已知干冰晶胞边长为a pm,则该晶体的密度为g/cm3(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 |
K | 2.6 | 1.7 | 1.0 | 0.9 |
回答下列问题:
(1)该反应的化学平衡常数表达式K= .
(2)该反应为反应(填“吸热”或“放热”).
(3)增加H2O(g)的浓度,CO的转化率将(填“增大”、“减小”或“不变”).
(4)830℃时,向该容器中加入2molCO2与2molH2 , 平衡时CO2的体积分数是 .
(5)已知工业制氢气的反应为CO(g)+H2O(g)CO2(g)+H2(g),反应过程中能量变化如图所示.又已知2H2(g)+O2(g)═2H2O(g)△H=﹣484kJ/mol.结合图象写出CO完全燃烧生成CO2的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某种含有少量FeCl2杂质的FeCl3样品.现要测定其中铁元素的质量分数,实验采用下列步骤进行:①准确称量mg样品(在2~3g范围内);
②向样品中加入10mL 6molL﹣1的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重.
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是 .
(2)加入氯水后,反应的离子方程式为 .
(3)若不用氯水,可用下列试剂中的代替(填序号).
A.H2O2
B.碘水
C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 .
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
元素 | Mn | Fe | |
电离能/kJmol﹣1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素价电子层的电子排布式为 , 比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是 .
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 , 其中体心立方晶胞空间利用率为 . 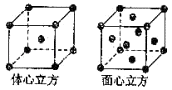
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可以有效防止这种现象发生。这说明维生素C具有
A. 还原性 B. 氧化性 C. 碱性 D. 酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com