
下列各组离子能在指定环境中大量共存的是:
A.在c(HCO3-)=0.1 mol.L-1的溶液中:NH4+、AlO2—、Cl-、NO3—
B.在由水电离出的c(H+)=l×l0-12 ·mol.L-1的溶液中:Fe2+、ClO-、Na+、SO42-
C.在加入铝粉产生H2的溶液中:SO42-、NO3一、Na+、NH4+
D.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、F—
D
【解析】
试题分析:A.在c(HCO3-)=0.1 mol/L的溶液中AlO2—与碳酸氢根反应生成氢氧化铝和碳酸根离子,不能大量共存,A错误;B.在由水电离出的c(H+)=l×l0-12mol/L的溶液中水的电离平衡被抑制,溶液可能显酸性,也可能显碱性,不论显酸性还是显碱性,Fe2+与ClO-之间均发生氧化还原反应,不能大量共存,B错误;C.在加入铝粉产生H2的溶液中溶液可能显酸性,也可能显碱性,如果显酸性,则铵根离子不能大量共存,C错误;D.能使红色石蕊试纸变蓝的溶液显碱性,则SO32-、CO32-、Na+、F—之间均不反应,可以大量共存,D正确,答案选D。
考点:考查离子共存正误判断


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A.元素X的简单气态氢化物的热稳定性比W的弱
B.元素W的最高价氧化物对应水化物的酸性比Z的弱
C.原子半径的大小顺序:ry > rz > rw > rx
D.化合物YX、ZX2、WX3中化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)物质结构选修模块题
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解。这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是 ;其中水分子里的氧原子轨道的杂化类型是 。将过量氨气通入0.1 mol·L―1的蓝色硫酸铜溶液中逐渐形成深蓝色溶液,其离子方程式为: 。
(2)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。下图是金属钛的面心立方结构晶胞示意图,则钛晶体的1个晶胞中钛原子数为 ,钛原子的配位数为 。
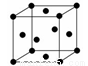
(3)晶体硅、锗是良好的半导体材料。磷化铝、砷化镓也是重要的半导体材料,从物质结构的角度分析它们与晶体硅的关系为 。试以原子实的形式写出31号半导体元素镓的电子排布式 。镓与砷相比较,第一电离能更大的是 (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列物质性质与相应结果或应用的对应关系正确的是
A.酸性越强的含氧酸跟铁片反应产生氢气越快
B.将草木灰和硫铵混合施用,可使肥效更高
C.Mg(OH)2和Al(OH)3受热易分解,常用它们作阻燃剂
D.某地雨水经过一段时间,其pH由4.68降为4.28,因为水中溶解了较多的CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:填空题
(13分)SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:

已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
②BaCO3的相对分子质量是197; BaCl2.2H2O的相对分子质量是244。
(1)SiCl4发生水解反应的化学方程式 。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式 。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2;② ;
(4)生成滤渣A的离子方程式: ;
(5)BaCl2滤液经 、 、过滤、洗涤,再经真空干燥后得到BaCl2.2H2O。
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_ 吨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:填空题
[化学—选修2化学与技术](15分)
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:

(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式为 。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在8090℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离时液溴从分离器 (填“上口”或“下口")排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、S02吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g/L,已知步骤①⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:选择题
下列装置应用于实验室制备氯气并回收氯化锰的实验,能达到实验目的的是
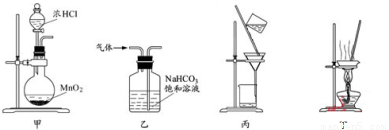
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】(15分)
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
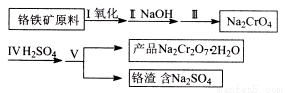
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A.升高温度 B.通入过量的空气
C.将原料粉碎 D.增加纯碱的用量
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列说法正确的是
A.溶液中所有离子浓度均减小
B.pH的变化值等于2
C.溶液中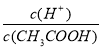 保持增大趋势
保持增大趋势
D.分别与足量的Mg粉反应,0.01 mol/L的醋酸溶液产生的氢气较少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com