
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
①若在500℃时进行反应,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为 。
②800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
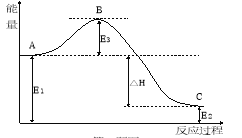
该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低” )△H (填“变大”、“变小”或“不变”);
(3)已知某反应的平衡常数表达式为:![]() ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为
【答案】(10分每空2分)
(1)①、75%、②大(2)降低;不变
(3)C(s)+H20(g)![]() H2(g)+CO(g)
H2(g)+CO(g)
【解析】
试题分析:(1)③若在500℃时进行,平衡常数K=9,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为,设一氧化碳消耗物质的量浓度为x,
CO(g)+H2O(g)H2(g)+CO2(g)
起始量(mol/L) 0.02 0.02 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.02-x 0.02-x x x
![]() =9,x=0.015mol/L,一氧化碳的转化率=0.015mol/L÷0.02mol/L×100%=75%;
=9,x=0.015mol/L,一氧化碳的转化率=0.015mol/L÷0.02mol/L×100%=75%;
④800℃时,K=1,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,Qc=![]() >K=1,反应逆向进行,则反应开始时,H2O的消耗速率比生成速率小;
>K=1,反应逆向进行,则反应开始时,H2O的消耗速率比生成速率小;
(2)反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变,该反应通常用V2O5作催化剂,加V2O5会使图中B点降低;
(3)已知某反应的平衡常数表达式为![]() ,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应前后元素守恒得到化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)。
,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应前后元素守恒得到化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为______________,G的原子结构示意图是___________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为____________________,所含化学键类型为___________________。向甲中滴加足量水时发生反应的化学方程式是___________________________。
(3)E、F、G形成的简单离子,半径由大到小顺序是____________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则b极是该电池的_____极,负极的电极反应式为_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。
(1)根据下图写出合成氨的热化学方程式是________________________。

(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___________(填“大于”、“等于”或“小于”)92.2 kJ,原因是______________;若加入催化剂,ΔH________(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N≡N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(4)N2H4可视为NH3分子中的H被-NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)==2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·江苏化学,13,4分)根据下列实验操作和现象所得到的结论正确的是(双选)( )
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1 mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5。 | HSO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M(C25H44O8)是一种新型治疗高血压病的药物,工业上用淀粉、烃A为基本原料合成M的路线如下图所示。
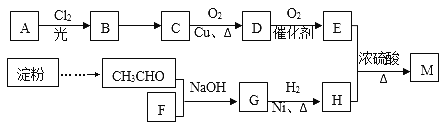 已知:
已知:
I.烃A在质谱图中的最大质荷比为72,B分子中核磁共振氢谱有2个峰且面积比为9:2,35%-40%的F的水溶液被称为福尔马林。
II.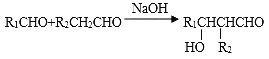
(1)A的名称为__________(系统命名法),B的结构简式为_______________,F的分子式为_____________;
(2)B→C的反应条件是______________,G的官能团名称是_____________;
(3)D与银氨溶液反应的方程式_____________________;
(4)E与H反应生成M的方程式___________________;
(5)E有多种同分异构体,其中能发生银镜反应且属于酯类的同分异构体共有____________种,其中核磁共振氢谱有2个峰的物质结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
![]()
A.X原子可能为第ⅤA族元素
B.Y原子一定为第ⅠA族元素
C.该分子中既含有极性共价键又含有非极性共价键
D.从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些中国古文或谚语包含了丰富的化学知识,下列解释不合理的是
选项 | 古文或谚语 | 化学解释 |
A | 粉身碎骨浑不怕,要留清白在人间 | 发生了化学变化 |
B | 以曾青涂铁,铁赤色如铜 | 化合反应 |
C | 煮豆燃豆箕 | 化学能转化为热能 |
D | 雷雨肥庄稼 | 自然固氮 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() U原子核的中子数与质子数之差为____________。
U原子核的中子数与质子数之差为____________。
(2)为了便于理解物质的组成,Fe3O4可改写为FeO· Fe2O3 则 Pb3O4可改写为:__________。
(3)O3、NH4NO3、K2O2、N2H4四种物质中,既有离子键又有非极性键的是_____________。
(4)金刚石、NaOH、干冰三物质中,熔化时需要破坏共价键的是________。
(5)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是共价化合物,可以证明该判断正确的实验依据是_____ (填字母序号)
A.AlCl3 可溶于水 B.AlCl3溶液可导电 C.熔化态的AlCl3不导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com