
【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
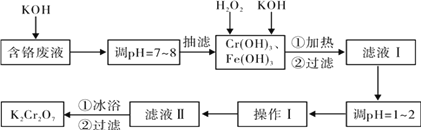
已知:①Cr(OH)3 + OH- = CrO2- + 2H2O; ②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。
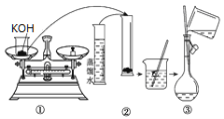
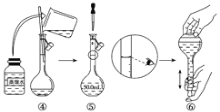
①请你观察图示判断,其中不正确的操作有(填序号)________;
②其中配制250 mL溶液的体积容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是_________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL 淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式_________。
②滴定终点的现象为_________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
【答案】②⑤ 250mL容量瓶 偏小 除去H2O2 除去晶体表面残留的杂质,减小K2Cr2O7的损耗 Cr2O72-+6I-+6H+=2Cr3++3I2+7H2O 加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色 88.2% 偏高
【解析】
实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收,先加KOH把Cr3+、Fe3+转化沉淀分离出来,再向沉淀中加双氧水和KOH,发生Cr(OH)3+OH-=CrO2-+2H2O、2CrO2-+3H2O2+2OH-=2CrO42-+4H2O,把Cr(OH)3转化为CrO42-,酸性条件下CrO42-转化为Cr2O72-,通过蒸发浓缩,过滤得到K2Cr2O7,据此分析解答。
(1)①图中量筒不能溶解固体,应在烧杯中溶解后冷却转移到容量瓶中,定容时眼睛与凹液面的最低处相平,保持视线水平,图中定容时观察方法不合理,则图中②⑤错误,故答案为:②⑤;
②配制250mL溶液体积的容器为250mL容量瓶,故答案为:250mL容量瓶;
③图中仰视读数,导致溶液的体积V偏大,由c=![]() 可知,所配制的溶液浓度将偏小,故答案为:偏小;
可知,所配制的溶液浓度将偏小,故答案为:偏小;
(2)滤液Ⅰ酸化前,进行加热的目的是除去H2O2;冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是除去晶体表面残留的杂质,减小K2Cr2O7的损耗,故答案为:除去H2O2;除去晶体表面残留的杂质,减小K2Cr2O7的损耗;
(3)①重铬酸钾氧化碘化钠,Cr元素的化合价降低,I元素的化合价升高,反应的离子方程式为Cr2O72-+6I-+6H+=2Cr3++3I2+7H2O,故答案为:Cr2O72-+6I-+6H+=2Cr3++3I2+7H2O;
②滴定时发生的反应为I2+2S2O32-=2I-+S4O62-,用淀粉作指示剂,淀粉遇碘变蓝,当加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色,表示到达滴定终点,故答案为:加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色;
③由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,则250mL溶液含重铬酸钾的物质的量为n=![]() ×
×![]() =0.006mol,则所得产品中重铬酸钾纯度为
=0.006mol,则所得产品中重铬酸钾纯度为![]() ×100%=88.2%,故答案为:88.2%;
×100%=88.2%,故答案为:88.2%;
④若滴定管在使用前未用Na2S2O3标准溶液润洗,导致消耗标准液的V偏大,测定K2Cr2O7的含量增大,则测得的重铬酸钾的纯度将偏高,故答案为:偏高。


科目:高中化学 来源: 题型:
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡是一种无色有强烈的刺激性气味的液体,有腐蚀性,常用作媒染剂和有机合成上的氯化催化剂。工业上常用氯气与金属锡或 SnCl2 来制得。某化学兴趣小组把干燥氯气通入熔融 SnCl2 2H2O中制取无水SnCl4有如图所示的相关装置:
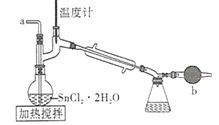
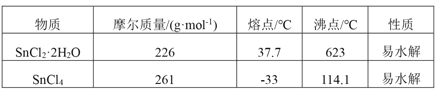
(1)盛装SnCl4的容器应贴上的安全警示标签是____________(填序号)。

(2)装置b的作用是______________________ 。
(3)为避免 SnCl4 水解,通Cl2 前应先除 SnCl2 的结晶水,其操作是_____________,在潮湿空气中 SnCl4 水解产生白色烟雾, 其化学方程式为 ________________ 。
(4)该学习小组最终制得的SnCl4 呈黄色,可能的原因是 ______________________,如果要除去黄色得到无色产品,你的做法是 ________________________。
(5)可以通过测定剩余SnCl4 的量来计算该次实验的产率, 方法是让残留的SnCl4 与足量硫酸铁铣反应,其中Fe3+被Sn2+还原为Fe2+。 然后在硫酸和磷酸混合条件下,以二苯胺磺酸钠作指示剂,用 K2Cr2O7 标准溶液滴定生成的Fe2+过程中的离子方程式为
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-+____Fe2++(______)____=_____Cr3++______Fe3++(_____)_____
①完成并配平上述方程式b。
②已知二苯胺磺酸钠还原态为无色,氧化态为紫色,则滴定达到终点的现象是____
③若实验前称取 22.6g SnC12H2O晶体于烧瓶中,实验结束后,向烧瓶内残留物中通入足量N2,取烧瓶内残留物溶于水配成250mL 溶液,取25mL于锥形瓶中,用以上方法滴定,消耗0.0l 00mol/L K2Cr2O7标准溶20.00mL, 则 SnCl4的产率最大值为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
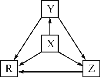
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)。
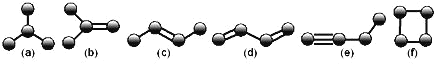
(1)写出有机物(a)的系统命名法的名称_____。
(2)有机物(e)有一种同类别的同分异构体,试写出其结构简式_____。
(3)上述有机物中与(c)互为同分异构体的是_____(填序号)。
(4)写一种与(b)互为同系物且所含碳原子数最少的有机物的结构简式_____。
(5)上述有机物中不能与溴水反应使其褪色的有_____(填序号)。
(6)写出有机物(d)反应生成高分子化合物的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A.Fe(OH)3溶于稀 H2SO4 中:H++OH﹣→H2O
B.氨水滴入AlCl3溶液中:Al3++3OH﹣→Al(OH)3↓
C.FeO溶于稀HCl中:O2﹣+2H+→H2O
D.铝溶解在NaOH溶液中:2Al+2OH﹣+2H2O→2AlO2﹣+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测、实验设计、仪器使用能达到目的的是( )
A.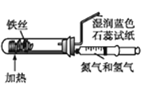 模拟工业制氨气检验产物
模拟工业制氨气检验产物
B.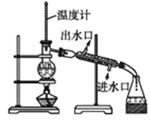 分离沸点不同的两种液体
分离沸点不同的两种液体
C.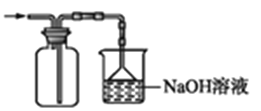 收集并吸收多余的氯气
收集并吸收多余的氯气
D. 盛放浓硝酸
盛放浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
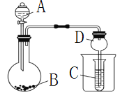
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com