
分析 (1)先求出偏二甲肼的物质的量,再根据物质的量之比等于热量比求出反应热,然后写出热化学方程式;
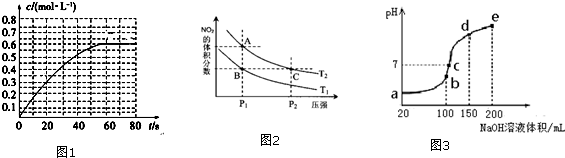
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,带入平衡常数表达式计算;
②a、压强越大,反应速率越快;
b、混合气体的平均相对分子质量=$\frac{混合气体质量总和}{混合气体的物质的量总和}$;
c、NO2的含量越高,混合气体的颜色越深;
d、可逆反应2NO2(g)?N2O4(g)△H=-a kJ•mol-1 (a>0)放热,温度升高平衡逆向移动,二氧化氮含量增大;
③反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、e三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.
②溶液中铵根离子浓度与一水合氨浓度最接近时,溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值;
③c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分.
解答 解:(1)1g燃料完全燃烧释放出的能量为42.5kJ,则1mol偏二甲肼完全燃烧释放出的能量为42.5kJ×60=2550kJ,其热化学方程式为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
故答案为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
(2)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,则K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.6mol/L}{(0.3mol/L)^{2}}$=6.67L/mol,
故答案为:6.67L/mol;
②a、压强越大,反应速率越快,所以A、C两点的反应速率:A<C,故a错误;
b、混合气体的平均相对分子质量=$\frac{混合气体质量总和}{混合气体的物质的量总和}$,BC两点混合气体的质量和物质的量都相等,所以混合气体的平均相对分子质量B=C,故b错误;
c、NO2的含量越高,混合气体的颜色越深,C点压强大于A点,加压平衡向生成N2O4的方向移动,但NO2的浓度比原平衡大,所以混合气体的颜色A点浅C点深,故c错误;
d、可逆反应2NO2(g)?N2O4(g)△H=-a kJ•mol-1 (a>0)放热,温度升高平衡逆向移动,二氧化氮含量增大,所以由状态B到状态A,可以用加热的方法,故d正确;
故答案为:d;
③反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,N2O4的浓度为0.3mol/L,浓度商Q=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.6mol/L}{(0.3mol/L)^{2}}$=6.67L/mol=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
故答案为:<;
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、e三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,因此水的电离程度最大的是b点,溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值,
故答案为:b;
②氨水为弱碱,溶液呈碱性,c点溶液呈中性,铵根离子浓度过大,e点溶液碱性过强,一水合氨浓度过大,相对而言d点溶液中铵根离子浓度与一水合氨浓度最接近,溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值,
故答案为:d;
③c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),c点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查知识点全面,涉及热化学方程式的书写、平衡常数的计算、平衡的移动、离子浓度大小比较、盐类水解等知识点,离子浓度大小比较常与盐类水解、弱电解质的电离联合考查,确定离子浓度大小时要结合电荷守恒、物料守恒来分析解答.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 63% | B. | 54% | C. | 12% | D. | 9% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | X单质可在氧气中燃烧生成XO3 | |
| C. | 离子半径大小:r (M3+)>r (T2-) | |
| D. | L2+和X2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2O、PCl3都是极性分子 | B. | CO2的分子示意图: | ||
| C. | H2O2的电子式: | D. | CS2、C6H6、C2H2都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 金属腐蚀的本质是金属原子失电子被氧化的过程 | |
| C. | 工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:| 硼酸三甲酯 | 甲醇 | |
| 相对分子量 | 104 | 32 |
| 溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
| 沸点/℃ | 68 | 64 |
| 备注 | 硼酸三甲酯与甲醇能形成共沸混合物,沸点54℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )| A. | 分子式为C20H20 | B. | 一氯代物的同分异构体只有四种 | ||
| C. | 分子中含有二个亚甲基(-CH2-) | D. | 分子中含有8个五元碳环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数 C>B>D>A | B. | 单质熔点 D>B,A>C | ||
| C. | 原子半径 D>B>C>A | D. | 简单离子半径 C>A>D>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com