
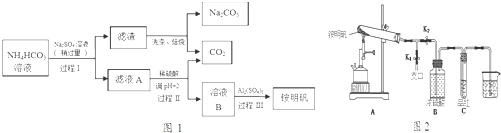
分析 碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾.
(1)铵明矾溶液中铝离子水解,溶液呈酸性,得到氢氧化铝胶体,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝;
(2)过程I利用溶解度不同发生复分解反应;
(3)HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀;
(4)用于铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥;
(5)(a)由题目信息可知有NH3生成,用蘸有浓盐酸的玻璃棒靠近支口检验氨气;装置A和导管中未见红棕色气体,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3;装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝;
(b)根据电子转移守恒确定n(N2):n(SO2),相同条件下气体体积之比等于其物质的量之比.
解答 解:碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾.
(1)铵明矾溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性;水解得到氢氧化铝胶体,可以吸附悬浮物质,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝,现象为:先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失,
故答案为:酸性;铵明矾溶液电离出的铝离子水解生成氢氧化铝胶体,有吸附作用,故铵明矾能净水;先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失;
(2)过程I利用溶解度不同发生复分解反应,反应方程式为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,
故答案为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ;
(3)省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低,
故答案为:省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低;
(4)用于铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:冷却结晶;
(5)(a)检验氨气方法为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;
装置A和导管中未见红棕色气体,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3,白色固体可能是(NH4)2SO3;
装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝,与氢氧化钠溶液反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;(NH4)2SO3;Al2O3+2OH-=2AlO2-+H2O;
(b)根据电子转移守恒:2×[0-(-3)]×n(N2)=n(SO2)×(6-4),故n(N2):n(SO2)=1:3,相同条件下气体体积之比等于其物质的量之比,故V(N2):V(SO2)=1:3,
故答案为:1:3.
点评 本题考查制备实验方案设计、物质组成的测定,明确工艺流程原理是解题关键,综合考查学生分析解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通常用单位时间内反应物或生成物的物质的量浓度变化来表示 | |
| B. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 若某化学反应的反应速率为0.5mol/(L•s),就是指在1s内反应物和生成物的浓度变化都为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
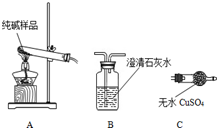 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com