
【题目】按要求填空。
(1)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,氧化剂与还原剂的物质的量之比是_____,当有2molHNO3参加反应时,被氧化的物质是____g,电子转移数目约为_____个。
(2)在反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
(3)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为不可能实现的是______。
(4)今有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最强的物质的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL浓度为0.05mol·L-1的Na2SO3溶液恰好与25mL浓度为0.02mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是_______。
【答案】2∶1 32 6.02×1023 SO2 SO2 3∶1 ② B C +3
【解析】
(1)反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,所以Cu是还原剂,HNO3→NO2,N元素由+5价→+4价,所以HNO3为氧化剂,但反应中只有一半的HNO3作氧化剂,因此由反应方程式可知氧化剂与还原剂的物质的量之比等于化学计量数之比为2∶1;当有2molHNO3参加反应时,被氧化的物质是Cu,其质量为2mol×![]() ×64g/mol=32g;电子转移数目约为2mol×
×64g/mol=32g;电子转移数目约为2mol×![]() ×(2-0)×6.02×1023/mol=6.02×1023,故答案为:2∶1,32,6.02×1023。
×(2-0)×6.02×1023/mol=6.02×1023,故答案为:2∶1,32,6.02×1023。
(2)反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,只有S元素的化合价发生变化,K2S中S元素为-2价,H2SO4中S为+6价,SO2中S为+4价,所以K2S中S从-2价升高到+4价,H2SO4中S从+6降低到+4价,因此SO2既是氧化产物,又是还原产物;氧化剂是H2SO4,还原剂是K2S,参加反应的4分子硫酸中,有1分子表现酸性,生成硫酸钾,有3分子表现氧化性,因此氧化剂与还原剂的物质的量之比为3:1,故答案为:SO2,SO2,3∶1。
K2SO4+4SO2↑+4H2O中,只有S元素的化合价发生变化,K2S中S元素为-2价,H2SO4中S为+6价,SO2中S为+4价,所以K2S中S从-2价升高到+4价,H2SO4中S从+6降低到+4价,因此SO2既是氧化产物,又是还原产物;氧化剂是H2SO4,还原剂是K2S,参加反应的4分子硫酸中,有1分子表现酸性,生成硫酸钾,有3分子表现氧化性,因此氧化剂与还原剂的物质的量之比为3:1,故答案为:SO2,SO2,3∶1。
(3)氧化还原反应中元素化合价有升必有降。①中,NO、HNO3中氮的化合价分别为+2价、+5价,生成N2O3(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现;②中,NH3、NO中氮的化合价分别为-3价、+2价,生成HNO2(氮的化合价为+3价)的过程中氮元素的化合价都是升高,此反应不可能实现;③中,N2O4(氮的化合价为+4价)生成HNO3(氮的化合价为+5价)、HNO2(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现,故答案为:②。
(4)由反应①知氧化性Fe3+>I2,还原性I->Fe2+;由反应②知氧化性Cl2>Fe3+,还原性Fe2+>Cl-;由反应③知氧化性MnO4->Cl2,还原性Cl->Mn2+。由此推知:氧化性强弱顺序为MnO4->Cl2>Fe3+>I2,还原性强弱顺序为Mn2+<Cl-<Fe2+<I-。所以KMnO4可氧化Cl-、Fe2+和I-,Cl2可氧化Fe2+和I-,FeCl3只能氧化I-。所以只能选FeCl3氧化I-而使Cl-不被氧化,故答案为:B,C。
(5)n(Na2SO3)=0.05mol·L-1×0.03L=0.0015mol,n(K2R2O7)=0.02mol·L-1×0.025L=0.005mol,K2R2O7和Na2SO3发生氧化还原反应生成Na2SO4,设R元素在还原产物中的化合价为x,根据转移电子守恒得0.0015mol×(6-4)=0.0005mol×2×(6-x),解得x=3,故答案为:+3。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-]
B.①②等体积混合后,醋酸根离子浓度小于③的二分之一
C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+)
D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物的结构简式如图所示: ![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)。下列说法正确的是
(c)。下列说法正确的是
A. 三种物质中只有a、b互为同分异构体
B. a、b、c分别有3种、4种、5种不同化学环境的氢原子
C. a、b、c均能发生氧化反应、取代反应、加成反应
D. c分子内至少有6个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
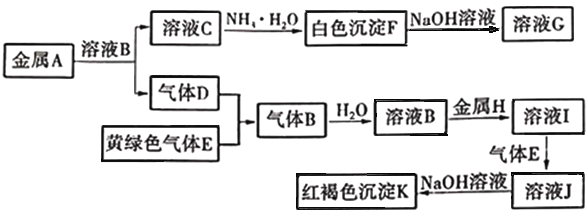
(1)写出下列物质的化学式:B是_________________, F是_________________,K是_________________。
(2)写出反应 “A→C”的离子方程式:_________________________________________。
(3)写出反应 “I→J”的化学方程式:_________________________________________。
(4)在溶液中滴加NaOH溶液,可观察到的现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)K元素的基态原子的电子填充于___个不同的能级。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为___,写出一种与[H2F]+具有相同空间构型和键合形式的阴离子是___。
(4)NH4F(氟化铵)可作为玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是___;氟化铵中存在___(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似BornHaber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为___kJ·mol-1,S—F的键能为___kJ·mol-1。
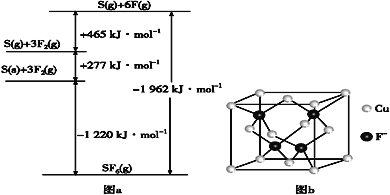
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是___;
②已知NA为阿伏加德罗常数的值。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
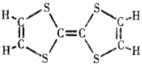
【题目】有机物M(C6H4S4)是隐形飞机上吸波材料的主要成分。某化学兴趣小组为探究其组成和分子结构,进行如下实验:
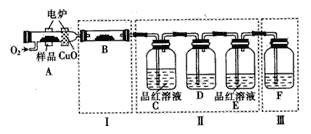
(1)将少量样品放入燃烧管A中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置(夹持仪器的装置已略去)。
①写出A中样品燃烧的化学方程式______。
②装置B的目的是验证有机物中含氢元素,则B中盛装的试剂可为______。
③D中盛放的试剂是______(填序号)。
a.NaOH溶液b.品红溶液c.KMnO4溶液d.饱和石灰水
④装置A中燃烧管放入CuO的作用是______。
⑤指出装置F的错误______。
(2)M的结构简式如图所示,4.08g M可使_____mol氢气发生反应,同样质量的M完全燃烧需要消耗氧气_____mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足图中所示物质转化关系且经过一步就能实现的是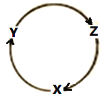
选项 | X | Y | Z |
A | Na | NaOH | Na2O2 |
B | Fe | FeCl2 | Fe(OH)3 |
C | NO | NO2 | HNO3 |
D | Al | Al2O3 | Al(OH)3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活等密切相关,从化学视角回答下列问题:
(1)电闪雷鸣的雨天,空气中发生的化学反应会增加雨水的含氮量,有关反应的化学方程式是_____、_______、_________________。
(2)我国以煤炭为主的能源结构决定了我国的酸雨以硫酸型为主,为减少SO2的污染和酸雨的形成,目前常应用石灰法脱硫。过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,最终生成CaSO4,有关反应的化学方程式为_______、______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com