
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) = 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = kJ/mol
2NH3(g) ΔH = kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=(只需代入数据,不用计算结果)
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式: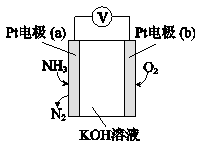
【答案】
(1)-92.2
(2)B,C
(3)0.82/(1.83×0.6);逆向
(4)4NH3 -12e- +12OH- =2N2+12H2O
【解析】(1)已知25℃时:①N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
②2H2(g) + O2(g) =2H2O(l) ΔH = -571.6 kJ/mol
③4NH3(g) + 5O2(g) =4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 根据盖斯定律①+②×3/2-1/2×③即得到N2(g) + 3H2(g) ![]() 2NH3(g) ΔH =-92.2kJ/mol;
2NH3(g) ΔH =-92.2kJ/mol;
(2)A.容器内N2、H2、NH3的浓度之比为1︰3︰2并不能说明正逆反应速率相等,则不一定达到平衡状态,A不符合题意;
B.3v(N2)正=v(H2)逆表示正逆反应速率相等,达到平衡状态,B符合题意;
C.正反应体积减小,容器内压强保持不变 说明反应达到平衡状态,C符合题意;
D.生成1mol N2的同时消耗2molNH3均表示逆反应速率,不能说明反应达到平衡状态,D不符合题意;
(3)①
N2(g) + | 3H2(g) | 2NH3(g) | |
起始(mol/L) | 1 | 3 | 0 |
转化(mol/L) | 0.4 | 1.2 | 0.8 |
平衡(mol/L) | 0.6 | 1.8 | 0.8 |
因为合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积,所以该反应的平衡常数表达式为K=c2(NH3) /c3(H2)c(N2)=0.82/(1.83×0.6);
②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应,起始时反应进行的方向为逆向;
(4)Pt电极通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原发生还原反应。负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3 -6e- +6OH-=N2+6H2O。
故答案为:(1)-92.2;(2)BC;(3)①0.82/(1.83×0.6);②逆向;(4)2NH3 -6e- +6OH-=N2+6H2O。
(1)根据盖斯定律计算目标反应的反应热;
(2)判断反应是否达到平衡状态,应分析所给选项条件是否体现“正逆反应速率相等”,若能体现正逆反应速率相等,则说明反应达到平衡状态;
(3)①根据三段式、平衡常数的表达式进行计算;
②结合等效平衡分析;
(4)由图可知a电极为负极,NH3发生失电子的氧化反应,转化为N2 , 结合溶液为碱性,书写电极反应式。


科目:高中化学 来源: 题型:
【题目】共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用力,下列含有上述两种相互作用力的晶体是( )
A. 碳化硅晶体 B. Ar晶体
C. NaCl晶体 D. NaOH晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 称取7.6g硫酸铜,加入500ml的水, B. 称取8.0g硫酸铜,加水500ml配成溶液。
C. 称取12.0g胆矾,配成500ml溶液, D. 称取12.5g胆矾,配成500ml溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. HF的稳定性很强,是因为HF分子之间能形成氢键
B. 水结成冰时,H—O键的键长变长,密度减小
C. 含氢元素的化合物中一定有氢键
D. 能与水分子形在氢键的物质易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列有关说法正确的是
A. 2.0gH182O与D2O的混合物中所含中子数为NA
B. 标准状况下,22.4L二氯甲烷的分子数约为NA个
C. 1molH2与足量O2反应生成的H2O中含有的共价健总数为NA
D. 在11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图每一方框中的字母代表一种反应物或生成物: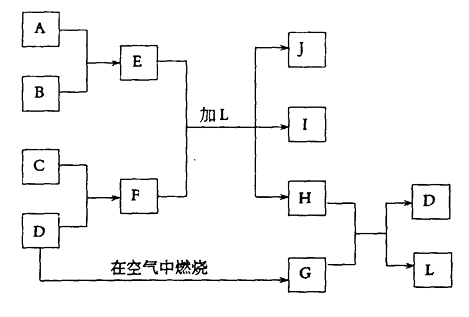
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为:
(2)用电子式表示F的形成过程
(3)写出E+F+L=J+I+H反应的离子方程式:
(4)H和G之间反应的化学方程式为: , 每生成2.4克的D转移 mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用地沟油制备乙醇,乙醇再加工制备多种化工材料。

(1)A的结构简式为_____________________________。
(2)“反应I”的现象是__________________________。
(3)B的官能团名称为______________________。
(4)实验室合成草酸二乙酯的步骤为:如图,在a中加入10.6g无水乙醇、9.0g无水草酸、脱水剂甲苯、催化剂TsOH(有机酸)和2~3片碎瓷片,在74~76℃充分反应。a中所得混合液冷却后依饮用水、饱和碳酸钠溶液洗涤,再用无水硫酸钠干燥。减压蒸馏,得到草酸二乙酯12.8g。
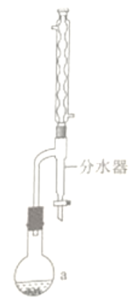
①仪器的名称是____,碎瓷片的作用是____________________________。
②合成过程最合适的加热方式是__________。
a.酒精灯直接加热 b.油浴 C.水浴 d.砂浴
③饱和碳酸钠溶液的作用是__________________________。
④合成草酸二乙酯的化学方程式为______________________________。
⑤草酸二乙酯的产率为____________________(保留小数点后一-位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com