
分析 (1)1g氢气完全燃烧生成液态水时放出142.9kJ热量,2g氢气燃烧生成液态水放热285.8KJ,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式书写;根据盖斯定律进行判断;
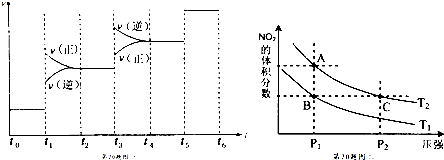
(2)根据图象分析影响平衡的因素;
②依据影响平衡的因素分析判断平衡移动,计算出平衡时各物质的浓度;
③N2O4(g)═2NO2(g)△H>0,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小.
a.A、C两点在等温线上,压强越大,反应速率越快;
b.增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
c.B、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等;
d.A、C两点温度相等,则平衡常数相同;
e.压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大;
解答 解:(1)1g氢气完全燃烧生成液态水时放出142.9kJ热量,2g氢气燃烧生成液态水放热285.8KJ,则氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1①
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;②
将方程式②×6-①×2得目标方程式,4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1530kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1530kJ/mol;
(2)N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,反应是放热反应,反应前后气体体积减小,
①依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t1-t2平衡正向移动,t3-t4平衡逆向移动,t5-t6平衡不移动,所以表示平衡混合物中NH3的含量最高的一段时间是t2-t3,故答案为:增大压强;t2-t3;
②若在恒温、恒压条件下向平衡体系中通入氩气,为保持恒压,体积增大,平衡向逆向进行;催化剂改变反应速率,不改变化学平衡,反应焓变不变;温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数可以列出三段式计算平衡浓度,依据平衡常数概念计算:
N2(g)+3H2(g)?2NH2(g)
开始(mol/L) 2a 4a 0
反应(mol/L) a 3a 2a
平衡(mol/L) a a 2a
所以化学平衡常数K=$\frac{(2a)^{2}}{a×{a}^{3}}$=$\frac{4}{{a}^{2}}$,故答案为:$\frac{4}{{a}^{2}}$;
③a.由图象可知,A、C两点在等温线上,C的压强大,则A、C两点的反应速率:A<C,故a正确;
b.A、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比A的浓度高,NO2为红棕色气体,则A、C两点气体的颜色:A浅,C深,故b正确;
c.B、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等,则平均相对分子质量相等,故c错误;
d.A、C两点温度相等,则平衡常数相同,故d错误;
e.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故e正确,
故选:abe.
点评 本题考查化学平衡计算、化学平衡图象、平衡常数、反应热计算等,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②④ | C. | ①②④⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
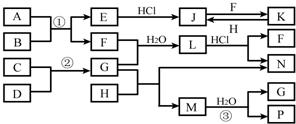 如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).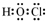 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质A的转化率增大了 | B. | 平衡向正反应方向移动 | ||
| C. | 物质C的体积分数增大了 | D. | a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
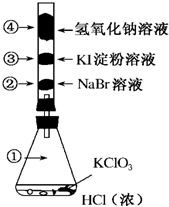 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )| A. | ①黄绿色 ②橙色 ③蓝色 ④白色 | B. | ①无色 ②橙色 ③紫色 ④白色 | ||
| C. | ①黄绿色 ②橙色 ③蓝色 ④无色 | D. | ①黄绿色 ②无色 ③紫色 ④白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
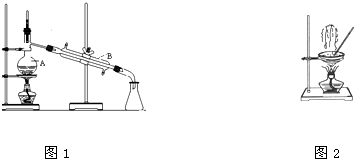 (1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com