
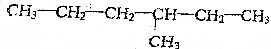
分析 某烃A与过量H2充分加成后得到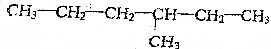 ,A可能为烯烃和炔烃,A中存在C=C或C≡C键,判断A的结构,应主要考虑C原子形成4个共价键,以此解答该题.
,A可能为烯烃和炔烃,A中存在C=C或C≡C键,判断A的结构,应主要考虑C原子形成4个共价键,以此解答该题.
解答 解:(1)若A为炔烃,则A的结构简式为CH≡C-CH2-CH(CH3)-CH2-CH3、CH3-C≡C-CH(CH3)-CH2-CH3、CH3CH2-CH2-CH(CH3)-C≡CH等,
故答案为:CH≡C-CH2-CH(CH3)-CH2-CH3;CH3-C≡C-CH(CH3)-CH2-CH3、CH3CH2-CH2-CH(CH3)-C≡CH;
(2)若A为单烯烃,则C=C可位于如图物质 ,共6种,故答案为:6.
,共6种,故答案为:6.
点评 本题以加成反应为载体,考查同分异构体的书写,为高频考点,理解加成反应原理是解题的关键,采取逆推法还原C≡C、C=C,注意分析分子结构是否对称,防止重写、漏写.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
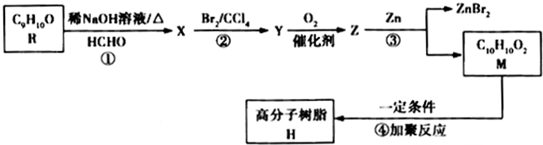
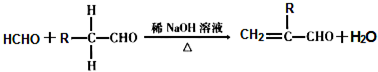
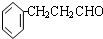 .
.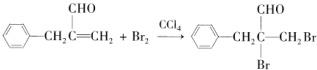 .
.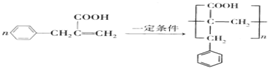 .
.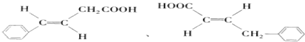 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
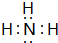 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
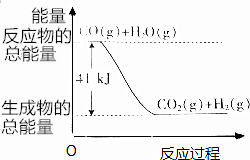 CO(g)+H2O(g)?CO2(g)+H2(g)反应的能量变化如图所示.下列反应既是氧化还原反应,又是放热反应的是( )
CO(g)+H2O(g)?CO2(g)+H2(g)反应的能量变化如图所示.下列反应既是氧化还原反应,又是放热反应的是( )| A. | 镁条在氧气中燃烧 | B. | 木炭与CO2反应 | ||
| C. | 硝酸和氢氧化钡溶液反应 | D. | CO2(g)+H2(g)=CO(g)+H20(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在溶质的物质的量相等的Na2A,NaHA两溶液中,阴离子总数相等 | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
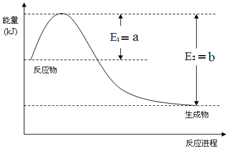 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com