
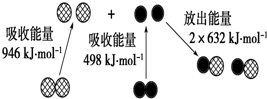
 (1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化:
(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化:| 1 |
| 2 |
| 1 |
| 2 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子数逐渐增多 |
| B、原子半径逐渐减小 |
| C、简单离子半径逐渐减小 |
| D、元素的最高化合价逐渐增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者都易溶于水 |
| B、两者都是有毒气体 |
| C、两者都能使品红溶液褪色 |
| D、两者都是形成酸雨的主要原因 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com