
下列分子或离子中,不存在sp3杂化类型的是( )
|
| A. | SO42﹣ | B. | NH3 | C. | C2H6 | D. | SO2 |
考点:
原子轨道杂化方式及杂化类型判断.
专题:
化学键与晶体结构.
分析:
分子或离子中,存在sp3杂化类型的原子含有4个价层电子对,价层电子对数=σ 键个数+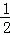 (a﹣xb),据此分析判断.
(a﹣xb),据此分析判断.
解答:
解:A.硫酸根离子中,价层电子对数=σ 键个数+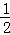 (a﹣xb)=4+
(a﹣xb)=4+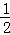 (6+2﹣4×2)=4,所以采取sp3杂化,故A不选;
(6+2﹣4×2)=4,所以采取sp3杂化,故A不选;
B.氨气分子中,价层电子对数=σ 键个数+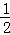 (a﹣xb)=3+
(a﹣xb)=3+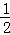 (5﹣3×1)=4,所以采取sp3杂化,故B不选;
(5﹣3×1)=4,所以采取sp3杂化,故B不选;
C.乙烷分子中,每个碳原子的价层电子对数=4,不含孤电子对,所以采取sp3杂化,故C不选;
D.二氧化硫分子中,价层电子对数=2+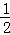 (6﹣2×2)=3,所以采取sp2杂化,故D选;
(6﹣2×2)=3,所以采取sp2杂化,故D选;
故选D.
点评:
本题考查了分子或离子中原子轨道杂化类型的判断,易错选项是C,注意乙烷分子中碳原子和碳原子之间存在σ 键,导致每个碳原子都含有4个σ 键而不含孤电子对,所以采取sp3杂化,为易错点.


科目:高中化学 来源: 题型:
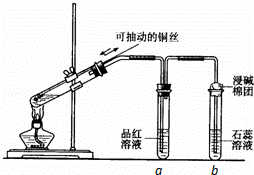
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式: .
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.
试管a中的现象是 ,作用是 .
试管b中的现象是 ,作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积相同的三个容器里分别充入三种气体①氢气;②二氧化碳;③氧气,并保持三个容器内气体的温度和密度均相等,下列说法正确的是()
A. 分子数目:①=②=③ B. 质量关系:①<③<②
C. 压强关系:①>③>② D. 原子数目:②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
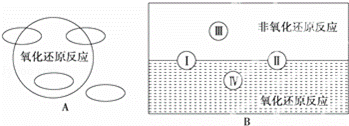
(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是 .
.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为分解反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式: .写出有水参加的符合反应类型Ⅳ的一个化学方程式: ,其中水为 剂.
(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号,下同);H2O被氧化的是 ,H2O被还原的是 ,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是 .
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由 价变为 价,被 ;Cl元素的原子失去电子,被 ;若参加反应的HCl是73g,则被氧化的HCl是 g.
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列原子或离子原子核外电子排布不属于基态排布的是( )
|
| A. | N:1s22s22p3 | B. | S2﹣:1s22s22p63s23p6 |
|
| C. | Na:1s22s22p53s2 | D. | Si:1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
|
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
|
| B. | NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
|
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
|
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内的O﹣H键、分子间的范德华力和氢键从强到弱依次为 . 的沸点比
的沸点比 高,原因是 .
高,原因是 .
(3)H+可与H2O形成H3O+,H3O+原子采用 杂化.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为元素周期表第4周期的一部分.据此判断下列说法中错误的是( )
|
| A. | 镍元素的符号为Ni |
|
| B. | 钴元素的相对原子质量是58.93g |
|
| C. | 从左到右各元素的原子序数依次增大 |
|
| D. | 各元素都属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列五种基团,﹣CH3、﹣OH、﹣CHO、﹣C6H5、﹣COOH,两两组成的物质中,能与NaOH反应的物质有多少种()
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com