
科目:高中化学 来源: 题型:填空题
 (1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
(1)如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnO | B. | K2CO3 | C. | Zn(OH)2 | D. | ZnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体溶于水后能导电,所以NaOH溶液是电解质 | |
| B. | H2SO4、Na2CO3、Ba(OH)2在水溶液中以离子的形式存在 | |
| C. | 液态氯化氢能导电,所以HCl是电解质 | |
| D. | NH3溶于水能导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其基态原子有26种能量不同的电子;
其基态原子有26种能量不同的电子;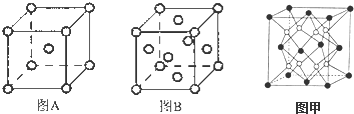
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气--CO | B. | 酒精--C2H5OH | C. | 金刚石--Si | D. | 石膏--CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com