
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
 Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;| 1mol×6 |
| 1 |
| 3 |
| ||
| 10 -14 |
| 10 -9 |


科目:高中化学 来源: 题型:
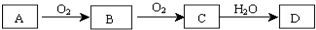
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在外电路中电子由正极流向负极 |
| B、在原电池中,只有金属锌作为负极 |
| C、原电池工作时,阳离子向正极方向移动 |
| D、原电池工作时,阳离子向负极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a和b不连接时,铁片上发生的反应为:Cu2++Fe═Cu+Fe2+ |
| B、a和b用导线连接时,Cu2+向铁电极移动 |
| C、a和b分别连接直流电源正、负极,铜片会溶解 |
| D、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2NaCl(s)+H2SO4(浓)
| ||||
B、C+2H2SO4(浓)
| ||||
C、Cu+2H2SO4(浓)
| ||||
D、2FeO+4H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1NaNO2 |
| 2维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8g | B、4.4g |
| C、10.6g | D、1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com