
| A、5.85 g |
| B、2.925 g |
| C、1.4625 g |
| D、2.836 g |


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、Fe与4mol/L稀HNO3 |
| B、Fe与0.4mol/L稀盐酸 |
| C、Fe与18.4mol/L浓H2SO4 |
| D、Fe与0.3mol/L稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是典型氯碱工业的关键设备--离子交换膜电解槽,该电解槽的特点是用离子交换膜将槽分隔为左右两室,它能够阻止一些物质通过,也能允许一些物质通过.下列有关说法正确的是( )
如图所示是典型氯碱工业的关键设备--离子交换膜电解槽,该电解槽的特点是用离子交换膜将槽分隔为左右两室,它能够阻止一些物质通过,也能允许一些物质通过.下列有关说法正确的是( )| A、离子交换膜的特点是允许气体分子通过,而不允许阴离子通过 |
| B、图中X是指氧气 |
| C、电解槽右室的电极反应式为2H++2e-═H2↑ |
| D、电解槽左室也称为阴极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、t℃时,某溶液的pH=6,则该溶液一定为酸性 |
| B、常温下,pH=8的氨水稀释后,溶液中所有离子的浓度均降低 |
| C、常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液的pH<7 |
| D、常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HCl溶液混合后,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在醋酸的稀溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加水一定能使电离平衡右移,氢氧根离子浓度增大 |
| B、pH=2的一元强酸HR溶液与pH=12的NaOH溶液等体积混合后,混合液的pH等于7,则反应后的混合液:c(R- )=c(Na+) |
| C、把pH=2的 HCl和CH3COOH分别加水稀释相同倍数后,CH3COOH的pH比HCl的小 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O |
| B、Na2O2 |
| C、KClO3 |
| D、KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaHSO4═Na++HSO
| ||
| B、AlCl3═Al+3+3Cl- | ||
| C、KClO3═K++Cl-+3O2- | ||
D、Al2(SO4)3═2Al3++3SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
| B、需要加热方能发生一定是吸热反应 |
| C、若反应X+Y═M是放热反应,该反应一定不用加热 |
D、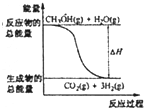 CH3OH(g)+H2O(g)═CO2(g)+3H2(g)反应能量变化如图所示,CH3OH转变H2的过程要吸收能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com