
����Ŀ��I.��֪ij���������к�������NaCl��Ϊ��ȷ�������д���������������ɲⶨ���ڻ�ѧ��Ӧ������CO2��������ʵ��װ�����£�����̨���г���������ʡ�ԣ���

���������գ�
��1��Bװ���е��Լ���_____________��������_____________________________��
��2��Dװ�õ�������___________________________________��
II.�ⶨ�����д�������������ij��ʵ�鲽�����£��ٽ�10.000g������������A�� �ڳ���C��U��+��ʯ�ң���ͬ��������Ϊl05.160g ��ʹ�÷�Һ©���μ��������ᣬʹ��ַ�Ӧ �ܴ�A�ĵ��ɼУ���������һ�����Ŀ��� ���ٴγ���C ���ظ�����ܺ͢ݣ����õ�C������Ϊ109.l66g��
��3��������У��μӵ������ѡ��________��
a��Ũ���� b��ϡ���� c��Ũ���� d��ϡ����
������____________________����ʱ���ɽ��еڢܲ�������
��4�������Ŀ����_______________________________________________��
��5����ʵ�����ݿ�֪�������д������������Ϊ_________________������3λС������
��6����ͬѧ������װ�òⶨij�����д�����������������ƫ�ߣ���������ҳ����ʵ������ԭ��_______________________________________________��
���𰸡� Ũ���� ����CO2���� ��ֹ�����е�ˮ������CO2�������C�и���ʵ��IJⶨ��� d A�в��ٲ������� �жϷ�Ӧ������CO2�����Ƿ�ȫ���ų�������U���еļ�ʯ�������� 0.965 ����Ŀ����к���CO2�ȣ���������
��������I.��1����Ʒ�м����ᣬ̼�������ᷴӦ���ɶ�����̼������ˮ�������ʣ���˻������Ҫͨ��Ũ���������ˮ��Ȼ�����ü�ʯ�����ն�����̼���壬������������̼������������Bװ���е��Լ���Ũ���ᣬ����CO2���� ����ȷ����Ũ��� ����CO2���� ��
��2��Dװ����ʢ�ŵļ�ʯ�ң��������Ƿ�ֹ�����е�ˮ������CO2�������C�и���ʵ��IJⶨ�������ȷ�𰸣���ֹ�����е�ˮ������CO2�������C�и���ʵ��IJⶨ�����
II.��3��Ũ������ϡ���� �����лӷ��������������������Ȼ��������������Ӱ��ʵ�����IJⶨ��Ũ��������ˮ�ų��������ȣ���Ӧ����̫�죬��ʯ�����ն�����̼���岻��ȫ������ʵ����ϡ�����ӷ����Һ���Ʒ��Ӧ�������ˣ�ʵ��Ч���ã���˲�����У��μӵ������ѡ��ϡ���ᣬ������A�в��ٲ�������ʱ�����ɽ��еڢܲ���������ȷ�𰸣�d ��A�в��ٲ������塣
��4������������ظ�����ܺ͢ݣ��ٴγ���C�������������ֵ�������ķ�Χ����˵����Ӧ������CO2�����Ѿ�ȫ���ų�������U���еļ�ʯ������������ȷ�����жϷ�Ӧ������CO2�����Ƿ�ȫ���ų�������U���еļ�ʯ����������
��5��װ��C���ӵ�����Ϊ��Ӧ����������̼��������������Զ�����̼����Ϊ��109.l66- l05.160��/44=0.091mol�����ݷ�Ӧ����ʽ��Na2CO3+H2SO4=Na2SO4+CO2��+H2O��֪��̼���Ƶ���Ϊ0.091mol������Ϊ0.091��106=9.65g�������д������������Ϊ9.65/10.000��100%=96.5%����ȷ����96.5%�� 0.965��
��6������Ŀ����к���CO2�����װ��C�����յĶ�����̼������������̼��������ƫ���ƫ�ߣ���ȷ�𰸣�����Ŀ����к���CO2�ȣ�����������


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C2H6��C5H12�ķ���������ǣ� ��
A. ��Ϊͬϵ��
B. C2H6ʧȥ1��H�õ����һ�ֻ��һ�ֽṹ
C. C5H12��һ�ȴ������ֻ��һ��
D. 2,2-��������ķе������ͬ���칹��ķе�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ����������ȷ���ǣ� ��
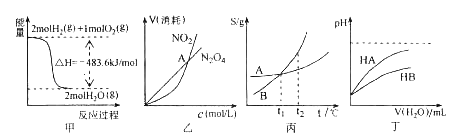
A���ױ�ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ483.6Kjmol��1
B���ұ�ʾ���º��������·����Ŀ��淴Ӧ2NO2![]() N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C������ʾA��B�����ʵ��ܽ�����¶ȱ仯�������A��B������Һ�ֱ���t1��������t2��ʱ�����ʵ���������B��A
D������ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����ͬŨ�ȵ�NaA��Һ��pHС��NaB��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ������Ũ�ȹ�ϵ��ȷ����(����)
A. pH��1��NaHSO4��Һ�� c(H��)��c(SO![]() )��c(OH��)
)��c(OH��)
B. ����AgCl��AgI���������Һ�� c(Ag��)>c(Cl��)��c(I��)
C. CO2��ˮ��Һ��c(H��)>c(HCO![]() )��2c(CO
)��2c(CO![]() )
)
D. �������ʵ�����NaHC2O4��Na2C2O4����Һ��3c(Na��)��2[c(HC2O![]() )��c(C2O
)��c(C2O![]() )��c(H2C2O4)]
)��c(H2C2O4)]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ʵ������480mL��0.5mol/L ��ϡ���ᣬijͬѧ��98%��Ũ��������=1.84g/cm3�� �������ƣ���ش���������:
��1�� ʵ����Ҫ�IJ������������ձ�����ͷ�ιܡ���������������Ҫ__________��
��2������: ������Ͳ��ȡŨ��������Ϊ__________ mL��
��3�� ���ƹ��̣�
������Ͳ��ȡ�����Ũ����
�ڽ�Ũ���Ỻ��ע��ʢ����������ˮ���ձ��У��ӱ߽��裬��ȴ������
���ò������������ձ��е���Һת�Ƶ��Ѿ���©�ĺ��ʹ�������ƿ��
��ϴ���ձ��Ͳ�����2~3 �Σ�ϴ��ҺҲע������ƿ�У�����ҡ������ƿ��ʹ��Һ��Ͼ���
�����������м�������ˮ���ھ���̶�1��2cm ʱ��Ȼ����
�Ǻ�ƿ�����������µߵ���ҡ�ȣ�
�߽����ƺõ���Һת�����Լ�ƿ�д��á�
����������һ���õ���ͷ�ιܵ���__________���������;
������ݶ���ʱ��ˮ�����̶��ߣ�Ӧ����δ���:___________��
��4�� �ں�������д���и����������������ҺŨ�ȵ�Ӱ����ѡ����ƫ��������ƫ����������Ӱ������.
�����õ�Ũ���᳤ʱ��������ܷⲻ�õ�������______��
����������ȡŨ����ʱ����Һ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�

(1)ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������������ClO2�ĵ缫��ӦʽΪ___________________________________________��
(2)���һ��ʱ�䣬�������������������Ϊ112 mL(��״��)ʱ��ֹͣ��⡣ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊ________mol��
��ij�о���ѧϰС����ݷ�Ӧ��2KMnO4��10FeSO4��8H2SO4===2MnSO4��5Fe2(SO4)3��K2SO4 �� 8H2O�������ԭ��أ����мס������ձ��и����ʵ����ʵ���Ũ�Ⱦ�Ϊ 1 mol��L��1����Һ�������Ϊ200 mL��������װ�б���K2SO4��Һ��

�ش��������⣺
(3)��ԭ��ص�������ʯī________(�a����b��)��
(4)��ع���ʱ�������е�SO![]() ����________(��ס����ҡ�)�ձ���
����________(��ס����ҡ�)�ձ���
(5)���ձ��еĵ缫��ӦʽΪ_______________________��
(6)����������Һ������仯��MnSO4Ũ�ȱ�Ϊ1.5 mol��L��1����Ӧ��ת�Ƶĵ���Ϊ____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪4NH3��5O2 ![]() 4NO��6H2O(g)������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)[mol��L��1��min��1]��ʾ������ȷ�Ĺ�ϵ��( )
4NO��6H2O(g)������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)[mol��L��1��min��1]��ʾ������ȷ�Ĺ�ϵ��( )
A��![]() v(NH3)��v(O2) B��
v(NH3)��v(O2) B��![]() v(O2)��v(H2O)
v(O2)��v(H2O)
C��![]() v(NH3)��v(H2O) D��
v(NH3)��v(H2O) D��![]() v(O2)��v(NO)
v(O2)��v(NO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������㷺Ӧ���ڵ����մɵȹ�ҵ������һ�������£�AlN��ͨ�����·�Ӧ�ϳɣ�Al2O3��N2��3C![]() 2AlN��3CO���йظ÷�Ӧ����������ȷ����
2AlN��3CO���йظ÷�Ӧ����������ȷ����
A. AlN�е��Ļ��ϼ�Ϊ-3 B. ������Ӧ�У�ÿ����1 mol N2��ת��3 mol����
C. AlN��Ħ������Ϊ41 g D. ������Ӧ�У�N2�ǻ�ԭ����Al2O3��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com