
分析 苯甲酸溶液用NaOH溶液滴定,滴定反应为: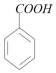 +NaOH→
+NaOH→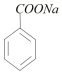 +H2O,计量点时,反应恰好生成
+H2O,计量点时,反应恰好生成 ,水解使溶液呈碱性,据此分析计算.
,水解使溶液呈碱性,据此分析计算.
解答 解:苯甲酸溶液用NaOH溶液滴定,滴定反应为: +NaOH→
+NaOH→ +H2O,计量点时,反应恰好生成
+H2O,计量点时,反应恰好生成 ,水解使溶液呈碱性,
,水解使溶液呈碱性,
(1)根据反应关系,苯甲酸溶液的浓度为c( )=$\frac{20.70mL×0.1000mol/L}{25.00mL}$=0.08280mol/L,
)=$\frac{20.70mL×0.1000mol/L}{25.00mL}$=0.08280mol/L,
答:浓度为0.08280mol/L;
(2)查表可知:苯甲酸的电离平衡常数为Ka=6.28×10-5,则苯甲酸钠的水解平衡常数Kb=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{6.28×1{0}^{-5}}$=1.59×10-10,
计量点时,溶液中恰好生成苯甲酸钠,其浓度为c0=$\frac{0.08280×25.00}{25.00+20.70}$=0.04530mol/L,
c0•Kb>20Kw,$\frac{{c}_{0}}{{K}_{b}}$>500,计量点的c(OH-)=$\sqrt{{c}_{0}•{K}_{b}}$=$\sqrt{0.04530×1.59×1{0}^{-10}}$=2.68×10-6,则pH=14-pOH=8.42,
答:pH为8.42;
(3)强碱滴定酸,则应选择的指示剂是酚酞,
答:酚酞.
点评 本题考查酸碱滴定原理,是大学无机化学和分析化学的知识,运算注意有效数字的运算规则,作为大学试题来讲,也在考研试题中出现过,注意求解溶液pH或pOH值时,最简式运用的条件,在无机化学和分析化学中不太一样,具体参看武汉大学《分析化学》教材,题目难度不大,是基础题.


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入NaHSO3溶液 | B. | 向水中加入NH4Cl溶液 | ||
| C. | 向水中加入CH3COONa 溶液 | D. | 将水加热到100℃,使 pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. )的一种同分异构体的结构简式
)的一种同分异构体的结构简式 或
或
 $→_{CH_{3}OH}^{H_{2}/Pd}$
$→_{CH_{3}OH}^{H_{2}/Pd}$ 请以CH3OH 和
请以CH3OH 和  为原料制备
为原料制备  ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2 | B. | FeCl3 | C. | KMnO4 | D. | KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间的转化关系如图所示.下列说法错误的是( )
已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间的转化关系如图所示.下列说法错误的是( )| A. | 若E、D的水溶液均呈酸性,则A为硫 | |
| B. | 若D是一种难溶于水的物质,则A为硅 | |
| C. | 若E、D的水溶液均呈酸性,则B能与水反应 | |
| D. | 若D是一种难溶于水的物质,则B能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com