
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
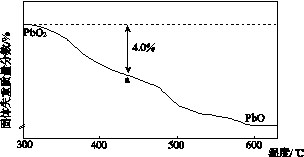
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即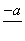 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
________________________________________________________________________
________________________________________________________________________。
(1)六 ⅣA 弱
(2)PbO4+4HCl(浓)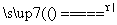 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
(3)PbO+ClO-===PbO2+Cl-
Pb2++2H2O-2e-===PbO2↓+4H+
石墨上包上铜镀层 Pb2++2e-===Pb↓ 不能有效利用Pb2+
(4)根据PbO2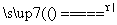 PbOx+
PbOx+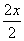 O2↑,有
O2↑,有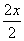 ×32=239×4.0%
×32=239×4.0%
x=2-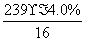 =1.4。
=1.4。
根据mPbO2·nPbO,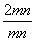 =1.4,
=1.4,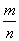 =
=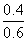 =
= 。
。
[解析] (1)由碳位于第二周期ⅣA族结合信息推出铅的位置;又由同主族元素性质的递变规律判断酸性;(2)PbO2与浓盐酸反应得到黄绿色的氯气,联想实验室制氯气写出化学方程式。(3)依题给信息知,反应物PbO与次氯酸钠反应,生成PbO2,由于Pb化合价升高,故另一生成物为Cl化合价降低得到的Cl-;阳极发生氧化反应,即Pb2+失去电子被氧化生成PbO2,同时考虑盐溶液水解得到的强酸性环境;阴极发生还原反应,即氧化性强的Cu2+得到电子生成铜;若电解液中不加入Cu(NO3)2,阴极发生的则是Pb2+得电子变为Pb,这样就不能有效利用Pb2+。(4)根据题意PbO2在加热过程中发生反应PbO2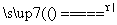 PbOx+
PbOx+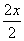 O2↑,减少的质量是氧气的质量,再利用质量关系计算。
O2↑,减少的质量是氧气的质量,再利用质量关系计算。


科目:高中化学 来源: 题型:
用NaOH固体配制1. 0 mol/L的NaOH溶液220 mL,下列说法正确的是
0 mol/L的NaOH溶液220 mL,下列说法正确的是
( )
A.首先称取NaOH固体10g
B.定容时仰视刻度线会使所配制的溶液浓度偏高
C.定容后将溶液振荡均匀,静置时发现液面低于刻度线,于是又加少量水至刻度线
D.容量瓶中原有少量蒸馏水对结果没有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
美国宇航局将在2012年再次登陆火星,新火星车体积更大、功能更全,旨在探寻火星土壤中是否存在有机物。已有资料表明:火星表面富含硅酸盐和硫酸盐;火星上的水以冰块和霜冻的形式存在于南北两极。下列叙述不正确的是( )
A.硅酸盐、硫酸盐都是含氧酸盐
B.水玻璃是混合物,冰水混合物是纯净物
C.Al2O3·2SiO2·2H2O属于氧化物
D.硅酸钠、硫酸钡、水分别属于强电解质、强电解质、弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组进行了Fe(OH)3胶体的制备:
将饱和三氯化铁溶液滴入沸水中时,液体变为________色,得到的是_______ _;反应的离子方程式为________________________________________________________。用此分散系进行实验:
_;反应的离子方程式为________________________________________________________。用此分散系进行实验:
(1)将其装入U形管内,用石墨作电极,接通直流电源,通电一段时间后,发现阴极附近颜色________________________________________________________________________,
这表明_____________________________________________________________,
这种现象称为___________________________________________________________。
(2)向其中加入饱和 的硫酸铵溶液,发生的现象是__________________________
的硫酸铵溶液,发生的现象是__________________________
________________________________________________________________________;
原因是____________________________________________________________。
(3)向其中逐滴加入过量稀硫酸,现象是___________________________________
________________________________________________________________________;
原因是___________________________________________________________
____________________________ ____________________________________________。
____________________________________________。
(4)提纯此分散系的方法叫___________________________________________________,
所选提纯装置是下列中的________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:
Ba2++2OH-+2H++SO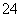 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:
2MnO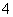 +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-===PbO2+4H++SO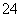
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
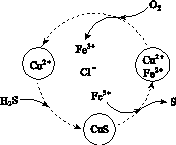
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中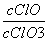 =
=
B.参加反应的氯气的物质的量等于 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: a mol≤ne≤
a mol≤ne≤ a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应Cr2O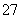 +3SO
+3SO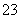 +aH+===2Cr3++3Y+4H2O,下列说法不正确的是( )
+aH+===2Cr3++3Y+4H2O,下列说法不正确的是( )
A.Y是SO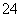
B.a=8
C.Cr2O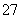 被氧化成Cr3+
被氧化成Cr3+
D.生成1 mol Cr3+时,转移的电子数是3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、鱼池增氧等。过氧化钙在常温下是白色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂。某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)。
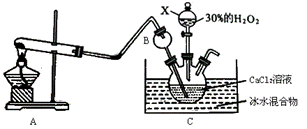
Ⅰ、第一部分:
(1)仪器B的名称为____________,作用是______________________。
(2)A为实验室制取氨气的装置,写出A中发生反应的化学方程式_______________。
(3)制取CaO2·8H2O一般在0℃~5℃的低温下进行,原因是________________;写出生成CaO2·8H2O的化学方程式________________________________________________。
Ⅱ、第二部分:
欲测定产品中CaO2的含量,实验步骤是:已知:I2 + 2S2O32- = 2I- + S4O62-
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(4)判断此滴定实验达到终点的方法是: 。
(5)CaO2的质量分数为 (用字母表示);
(6)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“无影响”、“偏低”或“偏高”)。[来源:Z|xx|k.Com]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com