
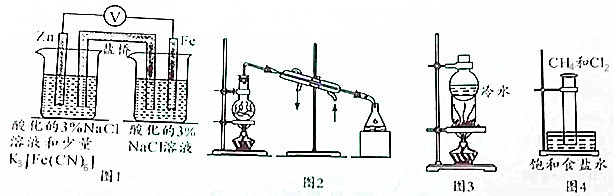
| A. | 用图1所示装置验证牺牲阳极的阴极保护法 | |
| B. | 用图2所示装置可在实验室制备蒸馏水 | |
| C. | 用图3所示装置可以进行NaCl与NH4Cl、NaCl与I2的分离 | |
| D. | 用图4所示装置进行CH4取代反应的实验 |
分析 A.图1为原电池锌做负极失电子发生氧化反应,铁做正极被保护;
B.蒸馏装置得到蒸馏水,给水加热冷凝后得到;
C.加热时碘升华遇冷凝结为固体,氯化铵分解生成的氨气和氯化氢会重新反应生成氯化铵;
D.甲烷和氯气光照发生取代反应生成取代产物和氯化氢气体;
解答 解:A.图1为原电池锌做负极失电子发生氧化反应,铁做正极被保护,检验亚铁离子生成的试剂铁氰酸钾应在铁电极的电解质溶液中,用来验证是否生成亚铁离子,所以用图1所示装置不能验证牺牲阳极的阴极保护法,故A错误;
B.蒸馏装置加热水蒸发,在直型冷凝管中冷却得到蒸馏水,用图2所示装置可在实验室制备蒸馏水,故B正确;
C.加热时碘升华,氯化铵分解,遇到冷的烧瓶底部会冷凝呈固体,分解生成的氨气和氯化氢结合生成氯化铵固体,则图中装置能分离混合物,故C正确;
D.甲烷和氯气光照发生取代反应生成取代产物和氯化氢气体,反应后装置内饱和食盐水在量筒中上升,内壁有油状物生成,可用图4所示装置进行CH4取代反应的实验,故D正确;
故选A.
点评 本题考查了实验方案的分析评价,主要是基本实验操作的掌握,注意原电池原理、混合物分离、取代反应等知识点的熟练应用,题目难度中等.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑦ | C. | ⑤⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
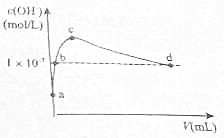 在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10m01•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7m01•L-1 | |
| C. | c点溶液中:c(K+)>c(HT-)>c(T2-) | |
| D. | d点溶液中:c(K+)=2c(T2-)+c(HT-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

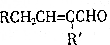 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)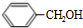 ;C中含有的官能团为碳碳双键、醛基(写名称).
;C中含有的官能团为碳碳双键、醛基(写名称).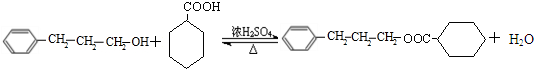 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com