
【题目】向四只盛有一定量NaOH溶液的烧杯中通入不同的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图:(忽略CO2的溶解和HCl的挥发) 
则下列分析都正确的组合是( )
①Ⅰ图对应溶液中的溶质为NaHCO3
②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3 , 且二者的物质的量之比为1:1
③Ⅲ图对应溶液中的溶质为NaOH和NaHCO3 , 且二者的物质的量之比为1:1
④Ⅳ图对应溶液中的溶质为Na2CO3 .
A.①②
B.①③
C.②④
D.②③
【答案】A
【解析】解:向一定量NaOH溶液的烧杯中通入不同量的CO2气体,当二氧化碳少量时,产物是NaOH和Na2CO3的混合物,当NaOH和CO2恰好完全反应时,产物只有Na2CO3 , 当二氧化碳过量时,产物可能只有NaHCO3 , 也可能是Na2CO3和NaHCO3的混合物.Ⅰ、图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3 , 故①正确;
Ⅱ、从图中看出刚滴下去盐酸一个单位后产生了二氧化碳,说明此时碳酸根的量是一个单位(盐多酸少,碳酸钠和盐酸一比一反应生成碳酸氢钠),后来盐酸加了两个单位才把所有二氧化碳反应出来,说明溶液中总的碳酸氢根量为两个单位,但有一个单位的是之前碳酸根得来的,所以原溶液中碳酸根的量和碳酸氢根的量相等,即c(Na2CO3)=c(NaHCO3),故②正确;
Ⅲ、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,且产生二氧化碳所消耗的盐酸也是两个单位,说明产物只有Na2CO3 , 物料守恒可知:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)+2c(H2CO3);故③错误;
Ⅳ、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明产物是NaOH和Na2CO3的混合物,一个单位的盐酸和NaOH反应,第二个单位的盐酸和Na2CO3反应生成NaHCO3 , 后由图中可看出,NaHCO3又消耗了一个单位的盐酸,则含有氢氧化钠和碳酸钠的量之比是1:1,故④错误.
由上分析知①②正确,③④错误,
故选:A.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列物质的化学性质与实际应用对应关系正确的是( )
化学性质 | 实际应用 | |
A | NH3具有碱性 | 用作制冷剂 |
B | SO2是酸性氧化物 | 用于纸张漂白 |
C | 漂白粉具有氧化性 | 用于漂白织物 |
D | FeCl3能与碱溶液反应 | 用于蚀刻铜制线路板 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 32gO2占有的体积约为22.4L
B. 22.4 LN2含有阿伏加德罗常数个氮分子
C. 在标准状况下,22.4L水的质量约为18 g
D. 22 g二氧化碳与标准状况下11.2 LHCl含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,不能产生可燃性气体的是( )
A.电石投入食盐水中B.铝片投入烧碱溶液中
C.无水乙醇与浓硫酸共热至170℃D.大理石投入稀盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、K+、ClO﹣ 都可在该物质的溶液中大量共存
B.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
C.向0.1molL﹣1该物质的溶液中逐滴滴加0.1molL﹣1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示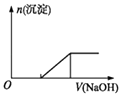
D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下四种物质:①标况下11.2L CO2②1g H2③1.204×1024个N2④4℃时18mLH2O,下列说法不正确的是( )
A.分子个数:③>④>①=②
B.原子个数:③>④>①>②
C.体积:③>④>①=②
D.质量:③>①>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,其制取原理为:Al2O3+3C+N2 ![]() 2AlN+3CO.在制取氮化铝时由于反应不完全,产品中有氧化铝和碳.为了分析某AlN样品的组成,某实验小组进行了如下探究.
2AlN+3CO.在制取氮化铝时由于反应不完全,产品中有氧化铝和碳.为了分析某AlN样品的组成,某实验小组进行了如下探究.
(1)【实验1】测定样品中氮元素的质量分数.
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
已知:AlN+NaOH+H2O═NaAlO2+NH3↑
(i)如图C装置中球形干燥管的作用是 .
(ii)完成以下实验步骤:组装好实验装置,首先 , 再加入实验药品.然后 ,
打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1 , 缓缓通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是 .
(iii)若去掉装置B,则导致测定结果偏高
(填“偏高”、“偏低”或“无影响”).由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 .
(2)【实验2】按以下步骤测定样品中铝元素的质量分数. 
(i)步骤②生成沉淀的离子方程式为 .
(ii)操作③需要的玻璃仪器有 .
(iii)过滤、洗涤
(iv)Al元素的质量分数为(用m1、m2表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl.某学生设计了如图所示方案提取纯净的NaCl溶液.(已知:NH4HCO3 ![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
(1)150℃时,一定量的NH4HCO3完全分解后所得气体的平均相对分子质量为 .
(2)操作③所得到的悬浊液与胶体的本质区别是 .
(3)进行操作②后,判断SO42﹣是否已除尽方法是 .
(4)操作②加BaCl2溶液后生成沉淀,不必进行过滤就可进行操作③加碳酸钠溶液,其理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是核电荷数均小于20的元素,其结构或性质信息如下表
元素 | A | B | C | D | E |
性质或结构信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
请根据表中的信息回答下列问题:
(1)D离子的结构示意图: , B原子的电子式: , E离子的电子式: .
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种: , .
(3)A元素与E元素组成的化合物的电离方程式: .
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是;写出钾离子的电子式: . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com