
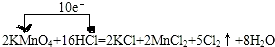 .
.分析 (1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表示氧化还原反应方程式时箭头由失电子的元素出发指向得电子的元素,在箭头的短线上标明转移的电子数目即可;
(2)所含元素化合价升高的是还原剂,所含元素化合价降低的是氧化剂;
(3)在氧化还原反应中,失电子化合价升高的元素被氧化体现还原性;如果有盐酸的氢离子参加了反应而酸根离子未参加反应,那么盐酸就表现出酸性;
(4)因为MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2.
解答 解:(1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为: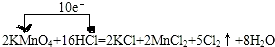 ;
;
故答案为: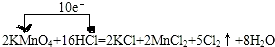 ;
;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O反应中,高锰酸钾中锰元素化合价降低,所以高锰酸钾做氧化剂,氯化氢中氯元素化合价升高,氯化氢为还原剂,故答案为:KMnO4;HCl;
(3)反应中氯元素的化合价升高,则氯元素失去电子,该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
故答案为:AB;
(4)MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2,造成空气污染;
故答案为:MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2.
点评 本题考查了氧化还原反应的相关概念和计算,明确氧化还原反应的实质是解题关键,注意分析化合价判断电子的转移数目,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
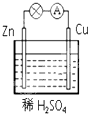 在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.
在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.93 g | B. | 5.85 g | C. | 6.56g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为35的氯原子:${\;}_{17}^{35}$Cl | B. | 氯化铵的电子式: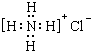 | ||
| C. | 硫化氢的结构式:H-S-H | D. | 二氧化硅的分子式:SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
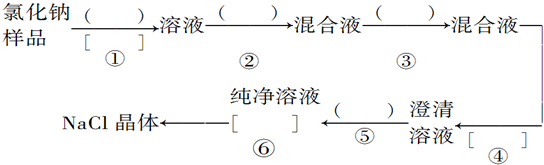
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
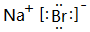 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com