
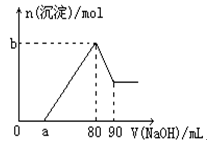
| A.盐酸的体积为80mL | B.a的取值范围为0<a<50 |
| C.n(Mg2+)<0.025mol | D.当a值为30时,b值为0.01 |
 。根据图像可知,溶解氢氧化铝消耗的氢氧化钠是10mol,所以根据方程式得到,氢氧化铝的物质的量是1mol/L×0.01L=0.01mol。而产生0.01mol氢氧化钠需要消耗的氢氧化钠溶液的体积是30ml,因为还有氢氧化镁生成,所以80ml-a>30ml,则a<50ml。若a=0时,说明在80ml的氢氧化钠溶液中有50ml是来产生氢氧化镁的,所以氢氧化镁的物质的量最多不能超过
。根据图像可知,溶解氢氧化铝消耗的氢氧化钠是10mol,所以根据方程式得到,氢氧化铝的物质的量是1mol/L×0.01L=0.01mol。而产生0.01mol氢氧化钠需要消耗的氢氧化钠溶液的体积是30ml,因为还有氢氧化镁生成,所以80ml-a>30ml,则a<50ml。若a=0时,说明在80ml的氢氧化钠溶液中有50ml是来产生氢氧化镁的,所以氢氧化镁的物质的量最多不能超过 。若a=30,则产生氢氧化镁的氢氧化钠溶液的体积是80ml-30ml-30ml=20ml,所以氢氧化镁的物质的量是
。若a=30,则产生氢氧化镁的氢氧化钠溶液的体积是80ml-30ml-30ml=20ml,所以氢氧化镁的物质的量是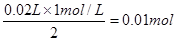 ,所以此时沉淀的物质的量是0.01mol+0.01mol=0.02mol,因此错误的选项是D,答案选D。
,所以此时沉淀的物质的量是0.01mol+0.01mol=0.02mol,因此错误的选项是D,答案选D。

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:不详 题型:单选题
| A.在常温常压下,11.2LN2含有的分子数为0.5NA |
| B.标准状况下,22.4L CCl4中含有氯原子数目为4NA |
| C.28gN2所含原子数为2 NA |
| D.23g钠在化学反应中失去电子数目为10 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸的摩尔质量是98 g | B.1mol O2的质量是32 g /mol |
| C.2g氢气所含原子数目为2mol | D.标准状况下,11.2LCH4的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.20mol?L-1 | B.0.25mol?L-1 | C.0.30mol?L-1 | D.0.50mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.7g OH―所含电子数为0.9NA |
| B.标准状况下,11.2 L HCl 所含质子数为18NA |
| C.常温下,11.2 L Cl2所含原子数为NA |
| D.0.5 mol D2O 中所含质子数为5NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
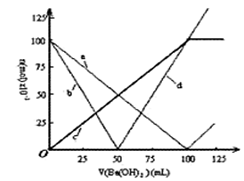
| A.曲线a表示H+的物质的量的变化 |
| B.直线d表示OH-的物质的量的变化 |
| C.曲线c表示Ba2+的物质的量的变化 |
| D.加入Ba(OH)2溶液50mL反应的离子方程式为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.5g甲基(—CH3)所含有的电子数是NA |
| B.14g乙烯和丙烯的混合物中含有原子的数目为NA |
| C.标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA |
| D.常温常压下,1mol CnH2n+2中所含有的共价键数目为(3n+1)NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com