

 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 ;
;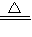 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;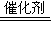 2CO2+N2中气体减少,则△S<0非自发,由反应能够自发进行,则△H-T△S<0,即该反应一定是放热才有可能自发进行,放热反应的△H<0,
2CO2+N2中气体减少,则△S<0非自发,由反应能够自发进行,则△H-T△S<0,即该反应一定是放热才有可能自发进行,放热反应的△H<0,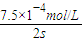 =3.75×10-4mol?L-1?s-1;
=3.75×10-4mol?L-1?s-1; υ(NO)≈1.875×10-4mol?L-1?s-1,
υ(NO)≈1.875×10-4mol?L-1?s-1, =5000,
=5000,

科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
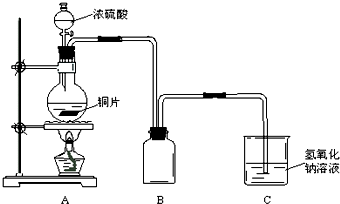
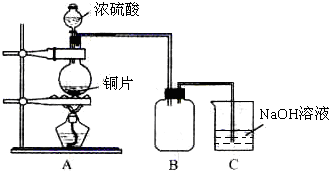
 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.
某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com