
A、分子式为C8H10的芳香烃有3个,分别为 、 、 和 和  |
| B、分子式为C2H6O的同分异构体有两个,分别是 H3C-O-CH3 和 CH3CH2OH |
| C、分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 |
D、 和 和 是两种不同的物质 是两种不同的物质 |
 ,共4个,故A错误;
,共4个,故A错误; 和
和 是同一种物质,故D错误,故选B.
是同一种物质,故D错误,故选B.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是一种国际基本物理量 |
| B、通常状况下,气体摩尔体积约为22.4L |
| C、CO2的摩尔质量是44g |
| D、在同温同压下,相同体积的任何气体所含分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠与氯化铜溶液:2OH-+Cu2+=Cu(OH)2↓ |
| B、石灰石与盐酸:CO32-+2H+=CO2↑+H2O |
| C、氯气与碘化钾溶液:Cl2+2I-=2I+2Cl- |
| D、用氢氧化钠溶液除去铝表面的氧化膜:AlO+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 丁达尔效应是区分胶体与溶液的一种最常用的方法.
丁达尔效应是区分胶体与溶液的一种最常用的方法.查看答案和解析>>
科目:高中化学 来源: 题型:

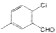 )是D的一种同系物,在H的同分异构体中,同时满足下列条件的物质的结构简式为
)是D的一种同系物,在H的同分异构体中,同时满足下列条件的物质的结构简式为 为起始原料,其他试剂任选,设计制备化合物
为起始原料,其他试剂任选,设计制备化合物 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸的种类 | 酸的浓度(mol?L-1) | NaOH的浓度(mol?L-1) | 混合后溶液的pH |
| HA | 0.1 | 0.1 | a |
| HB | 0.12 | 0.1 | b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com