
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是

A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B.醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C.在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO42-=BaSO4+2H2O
D.向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

(1)用KSCN溶液检验出Fe3+的现象是_______________________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _____________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
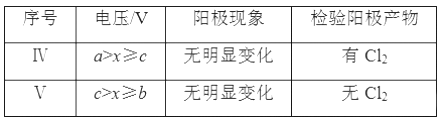
①NaCl溶液的浓度是________ mol·L-1。
②Ⅳ中检测Cl2的实验方法:______________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H <0。请回答下列问题:
2SO3(g) △H <0。请回答下列问题:
(1)某温度下,在一固定体积为2升的密闭容器中,充入2molSO2和lmolO2发生上述反应,当反应进行到2分钟末时达到平衡,平衡混合物中SO3的质量分数为50%,则反应前2分钟内用SO2表示的平均反应速率为_____,SO2的转化率为____,此时反应的平衡常数为_________。
(2)在某恒温、恒压容器中,按体积比2: 1加入SO2和O2进行上述反应,达到平衡后,再向容器中充入适量SO3(g),达到新平衡时,c(O2)将比原平衡_____(填“增大”、“减小”、或“不变”)
(3)若在某恒温、恒容容器中,加入一定量SO3(g)发生上述反应,达到平衡后,再向容器 中充入适量SO3(g),达到新平衡时,c(SO2)/c(SO3)将比原平衡______(填“增大”、“减小”、或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为![]()
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 原子半径大小:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是

A. 该温度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三点所示溶液中c(Ag+):al>b>c
C. 若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D. 用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)俄美科学家联合小组宣布合成出114号元素(FI)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置______________,属于金属元素还是非金属元素?____
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________________。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
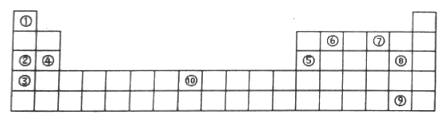
(1)元素⑦的氢化物与⑧的单质反应的离子方程式为__________。
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________。
(3)元素Fe的单质与⑦的氢化物高温下反应的化学方程式为___________。
(III)判断以下叙述正确的是__________。
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3![]() 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com