
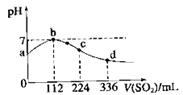
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,
所得溶液pH变化如图中曲线所示。下列分析正确的是
A.原H2S溶液的物质的量浓度为0.05 mol/L
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
科目:高中化学 来源: 题型:
下列反应转化关系(未配平)肯定不正确的是( )
A.S+KOH→K2SO3+K2S+H2O B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu20+H2SO4→CuSO4+Cu+H2O D.NH4NO3→N2O↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入适量的反应物A和B发生反应:aA(g)+bB(g)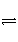
 dD(g)+eE(g) ΔH,随着反应的进行,不断升高温度,产物D的百分含量随温度的变化如图所示。回答下列问题:
dD(g)+eE(g) ΔH,随着反应的进行,不断升高温度,产物D的百分含量随温度的变化如图所示。回答下列问题:
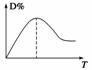
(1)ΔH______0(填“<”、“>”或“=”)。
(2)同时升高一定温度和增加一定压强,平衡不移动,则a、b、d、e的关系是a+b______d+e(填“>”、“<”或“=”)。
(3)增大压强,平衡移动,新平衡与旧平衡对比,A的平衡浓度________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
1)估计下列各变化过程是熵增还是熵减。
①NH4NO3爆炸:2NH4NO3(s)===2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g)===CO2(g)+H2(g)
③臭氧的生成:3O2(g)===2O3(g)
(2)可逆反应A(g)+B(g)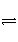
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如右图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如右图所示。
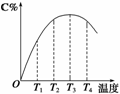
①由T1向T2变化时,正反应速率________逆反应速率。(填“>”、“<”或“=”)
②由T3向T4变化时,正反应速率________逆反应速率。(填“>”、“<”或“=”)
③反应在________温度下达到平衡。
④此反应的正反应为________热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B、CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C、Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2
D、25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
A.②④ B.②③④ C.①③⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物; ②天然气和水蒸气都是可再生能源; ③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金; ⑥盐酸和食醋既是化合物又是酸; ⑥纯碱和熟石灰都是碱; ⑦豆浆和雾都是胶体。上述说法正确的是
A.①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.c(NH4+) / c (NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
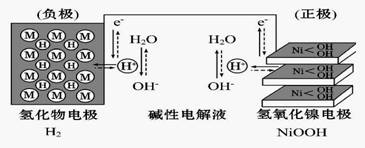
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是
A. 放电时电池内部H+向负极移动
B. 充电时,将电池的负极与外接电源的正极相连
C. 充电时阳极反应为Ni(OH)2+ OH-- e-====NiOOH+H2O
D. 放电时负极的电极反应式为MHn-ne- = M+nH+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com