
 pH=2的X、Y、Z三种酸的溶液各1mL,分别稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列正确的是 ( )
pH=2的X、Y、Z三种酸的溶液各1mL,分别稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列正确的是 ( )| A. | X、Y和Z都是弱酸 | B. | 稀释前的浓度大小为c(Z)>c(X)>c(Y) | ||
| C. | 稀释前电离程度大小为X>Y>Z | D. | pH=2时,X、Y、Z都是稀溶液 |
分析 加水稀释促进弱电解质电离,pH=2的三种酸,稀释1000倍后,如果该酸是强酸,则稀释后溶液pH=5,如果是弱酸,稀释后溶液的pH<5,根据图象知,X是强酸、Y和Z属于弱酸;
加水稀释弱酸过程中,如果弱酸电离增大程度大于溶液体积增大程度,则溶液中氢离子浓度增大,溶液的pH减小,反之,溶液pH增大,据此分析解答.
解答 解:A.加水稀释促进弱电解质电离,pH=2的三种酸,稀释1000倍后,如果该酸是强酸,则稀释后溶液pH=5,如果是弱酸,稀释后溶液的pH<5,根据图象知,稀释1000倍,X溶液的pH=5、Y和Z溶液pH小于5,所以X是强酸、Y和Z属于弱酸,故A错误;
B.pH相等时,弱酸浓度大于强酸,所以Y和Z浓度大于X,根据图象知,刚开始稀释时,Z的pH减小、Y的pH增大,说明Z是浓溶液、Y是稀溶液,则三种酸浓度大小顺序是c(Z)>c(Y)>c(X),故B错误;
C.强电解质X完全电离,Y和Z部分电离,溶液浓度越大其电离程度越小,所以稀释前电离程度大小为X>Y>Z,故C正确;
D.根据B知,pH=2时,X和Y属于稀溶液,Z属于浓溶液,故D错误;
故选C.
点评 题考查了弱电解质的电离,明确稀释弱酸时溶液pH变化是解本题关键,正确理解图中Z曲线出现拐点的原因,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 纯碱-Na2CO3 | B. | 熟石灰-Ca(OH)2 | ||
| C. | 明矾-Al2(SO4)3•12H2O | D. | 胆矾-CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氧化铜与硫酸溶液的反应:O2-+2H+═H2O | |
| C. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 硫酸铝溶液与稀氨水混合:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KOH溶液可以将NH4Cl、NaBr、CuSO4、FeCl3区别开 | |
| B. | C、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| C. | 某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32? | |
| D. | 某溶液中先滴加氯水,再滴加KSCN溶液后显红色,则此溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
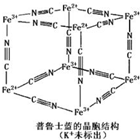 普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A. | 化学式可以表示为KFe2(CN)6 | |
| B. | 每一个立方体中平均含有24个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个Fe3+周围与之相邻的Fe2+离子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com