
【题目】阴离子Xn﹣含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )
A. (N﹣a)mol B. ![]() (n+A)mol
(n+A)mol
C. ![]() (N+n)mol D.
(N+n)mol D. ![]() (A﹣N+n)mol
(A﹣N+n)mol
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)n(SO4)3﹣n/2]m是一种新型高效的水处理混凝剂,某课题小组设计如下方案制备聚合硫酸铁,其简单工艺流程如图1:
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2 , 调节pH<3,加热煮沸;加入过量KI充分反应后,再用0.1 000molL﹣1 Na2S2O3标准溶液滴定至终点,消耗标准溶液VXmL.已知:I2+2S2O32﹣═I﹣+S4O62﹣ . .
(1)实验过程中加热煮沸的目的是 .
(2)在测定过程中加入足量H2O2发生反应离子方程式: .
(3)滴定过程中选择装标准溶液仪器(如图2)是否合理(填“是”或“否”)
(4)写出滴定选用的指示剂 , 滴定终点观察到的现象 .
(5)根据图1消耗的Na2S2O3标准溶液体积,计算出溶液Ⅰ中铁元素的总含量为gL﹣1 . 若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会(填“偏高”“偏低”或“不变”).
(6)上述流程中溶液Ⅰ中铁元素存在不同的离子,根据题意完成下面假设并设计实验方案证明假设假设1:溶液Ⅰ中只存在Fe2+ 假设2:溶液Ⅰ中只存在Fe3+ 假设3: .
根据提供试剂和实验用品验证假设3成立
限选实验试剂:1.0molL﹣1 NaOH溶液、8.0molL﹣1 NaOH溶液、0.01molL﹣1KMnO4、淀粉﹣KI溶液、3moLL﹣1H2SO4、紫色石蕊试液、0.1molL﹣1 K3[Fe(CN)6]溶液、试管、胶头滴管
实验步骤 | 预期现象和结论 |
步骤1:取少量溶液Ⅰ于试管A、B中 | |
步骤2: | |
步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( ) 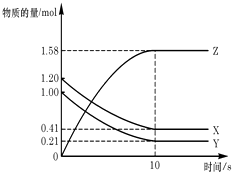
A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)═3Ag2O(s)△H=﹣235.8kJ/mol.
已知2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ/mol,
则常温下反应:2O3(g)═3O2(g)的△H= .
(2)科学家首先使用在酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,电极反应式为3H2O﹣6e﹣=O3↑+6H+ , 阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 .
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8并生成氧气.写出该反应的化学方程式:
(4)所得的Na2S2O8溶液可降解有机污染物4﹣CP.原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4﹣).通过测定4﹣CP降解率可判断Na2S2O8溶液产生SO4﹣的量.某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4﹣的影响.①溶液酸碱性的影响:其他条件相同,将4﹣CP加入到不同pH的Na2S2O8溶液中,结果如图a所示.由此可知:溶液酸性增强,(填“有利于”或“不利于”)Na2S2O8产生SO4﹣ . 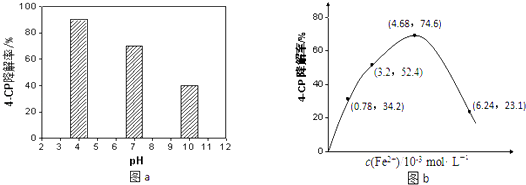
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4﹣CP)=1.56×10﹣4molL﹣1、c(Na2S2O8)=3.12×10﹣3 molL﹣1的混合溶液中.反应240min后测得实验结果如图b所示.已知 S2O82﹣+Fe2+═SO4﹣+SO42﹣+Fe3+ . 则由图示可知下列说法正确的是:(填序号)
A.反应开始一段时间内4﹣CP降解率随Fe2+浓度的增大而增大,原因是Fe2+能使Na2S2O8产生更多的SO4ˉ.
B.Fe2+是4﹣CP降解反应的催化剂
C.当c(Fe2+)过大时,4﹣CP降解率反而下降,原因可能是Fe2+会与SO4﹣发生反应,消耗部分SO4﹣.
D.4﹣CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于4﹣CP的降解.
③当c(Fe2+)=3.2×10ˉ3molL﹣1时,4﹣CP降解的平均反应速率的计算表达式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若3.01×1023个气体分子在某状况下的体积为22.4L,则该状况下的气体摩尔体积为
A. 11.2L/mol B. 22.4L/mol C. 44.8L/mol D. 67.2L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对的电子总数等于未成对的电子总数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.
(1)A,C形成的分子极易溶于水,与该分子互为等电子体的阳离子为 .
(2)比较E、F的第一电离能:E(填“>”或“<”)F.
(3)BD2在高温高压下所形成的晶胞如图所示.该晶体的类型属于(填“分子”“原子”“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 . 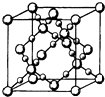
(4)单质F与强碱溶液反应有[F(OH)4]﹣生成,则[F(OH)4]﹣中存在(填字母). a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(5)Cu晶体是面心立方体,立方体的每个面5个Cu原子紧密堆砌,已知每个Cu原子的质量为a g,Cu原子半径为d cm,求该晶体的密度为gcm﹣3 . (用含a、d的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中进行如下反应:CO(g)+H2O(g)CO2(g)+H2(g),有如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
CO | H2O | CO2 | H2 | CO2 | ||
1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
下列说法正确的是( )
A.正反应为吸热反应
B.实验1中,CO的转化率为80%
C.650℃时,化学平衡常数K= ![]()
D.实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法不正确的是( )
A.聚氯乙烯分子中含碳碳双键
B.以淀粉为原料可制取乙酸乙酯
C.戊烷有3种同分异构体
D.油脂的皂化反应属于水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com