
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
分析 [RO(OH)2]+ 中R的化合价是+5价,该反应中,亚铁离子失电子生成铁离子,R元素得电子发生还原反应,在氧化还原反应中得失电子数相等,根据转移电子守恒进行计算.
解答 解:[RO(OH)2]+ 中R的化合价是+5价,该反应中,亚铁离子失电子生成铁离子,R元素得电子发生还原反应,
设R元素的最终价态为x,
根据转移电子守恒得:0.1mol/L×0.02L×(3-2)=1.0×10-3 mol×(5-x),
0.002mol=1.0×10-3 mol×(5-x),
解得:x=+3,
故选B.
点评 本题考查了氧化还原反应的有关计算,明确氧化还原反应中得失电子相等是解本题关键,根据转移电子守恒来分析解答即可,难度不大.


科目:高中化学 来源: 题型:实验题
 如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:
如图1所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
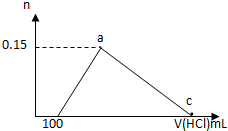 在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )| A. | 原AlCl3溶液的物质的量浓度为1.5mol/L | |
| B. | c点的体积为750mL | |
| C. | 原加入的NaOH的物质的量为0.7mol | |
| D. | a和c点间铝元素以AlO2-和Al(OH)3的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2与H2在一定条件下合成NH3 | B. | NO与O2反应生成NO2 | ||
| C. | NH3被O2氧化成NO和H2O | D. | 由NH3制备化肥NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$A12O3+2Fe | ||
| C. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | D. | KCl+Ag NO3═KNO3+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
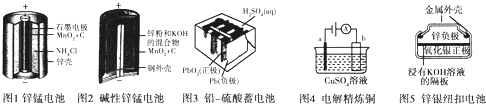
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com