
【题目】(1) 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,c(Ag+)由大到小的顺序为:_________。
(2) 含有Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() 。为了使废水的排放达标,进行如下处理:Cr2O
。为了使废水的排放达标,进行如下处理:Cr2O![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(a) 该废水中加入绿矾和H+,发生反应的离子方程式为__________________。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
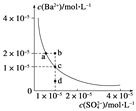
(a) 下列说法正确的是________(填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(b) 将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为__________。
【答案】 ④>①>②>③ Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O 3.0×10-6 mol·L-1 c 2.02×10-10 mol/L
+6Fe2++14H+===2Cr3++6Fe3++7H2O 3.0×10-6 mol·L-1 c 2.02×10-10 mol/L
【解析】(1)溶度积在一定温度下是一个常数,因此通过Ksp(AgCl)= c(Ag+)×c(Cl-)分别得到:①蒸馏水中含银离子浓度和氯离子浓度相同;②0.1molL-1盐酸溶液中氯离子浓度为0.1mol/L,抑制沉淀溶解平衡;③0.1molL-1MgCl2溶液中Cl-浓度为0.2mol/l,抑制沉淀溶解平衡;④0.1mol/L硝酸银溶液中Ag+浓度为0.1mol/L,抑制沉淀溶解平衡,Cl-浓度越大,Ag+浓度越小,则Ag+离子浓度大小为:④>①>②>③;正确答案:④>①>②>③ 。
(2) (a) 亚铁离子具有还原性,被Cr2O![]() 在酸性环境下氧化为铁离子,离子方程式为:Cr2O
在酸性环境下氧化为铁离子,离子方程式为:Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O;正确答案:Cr2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O;正确答案:Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1, Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25 mol·L-1,,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-31, c(Cr3+)= 3.0×10-6 mol·L-1 ;正确答案:3.0×10-6 mol·L-1。
(3) (1)硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移, c(Ba2+)应降低,A错误;d点时溶液不饱和,蒸发溶剂水, c(SO42-) 、c(Ba2+)均增大,B错误;d点表示QC< Ksp ,溶液不饱和,不会有沉淀析出,C正确;Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,D错误;正确答案:C。
(2)由图象可以知道Ksp(BaSO4)=10-5×10-5=10-10 ,将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,反应生成BaSO4,硫酸根离子过量,加入n(Ba2+)=0.137/137=0.001mol,剩余的硫酸根离子的浓度为:c(SO42-)=(0.1×1-0.001)/2=0.495mol/L,所以剩余的钡离子为:c(Ba2+)= Ksp(BaSO4)/c(SO42-)=10-10/0.495=2.02×10-10 mol/L;正确答案: 2.02×10-10 mol/L;正确答案:2.02×10-10 mol/L。


科目:高中化学 来源: 题型:
【题目】装有 Fe2O3、 CuO、 Fe、 Cu 的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
A. 一定有Fe2+,可能有Cu2+ B. 只有Fe2+
C. 一定有Fe2+、Cu2+,可能有Fe3+ D. 只有Fe2+和Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验中的说法正确的是
A. 将碘水倒入分液漏斗中,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B. 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C. 某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO![]()
D. 加浓溴水然后过滤可以除去苯中少量的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO![]() 、I-、CO
、I-、CO![]() ,现取三份20 mL该溶液进行如下实验:
,现取三份20 mL该溶液进行如下实验:
①第一份加入足量盐酸,无任何气体产生
②第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到x g固体
③第三份滴加0.10 mol·L-1酸性KMnO4溶液,恰好完全反应,消耗其体积为V mL
④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是
A. 由实验②、③可判定原混合溶液中是否存在I-
B. 由实验①可推断原混合溶液中是否含有SO![]()
C. 由实验③可判定原混合溶液中是否含有Fe2+
D. 原混合溶液中只存在Na+、Fe3+、SO![]() ,不可能存在K+、CO
,不可能存在K+、CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中加入铝粉有氢气产生,该溶液中肯定可以大量存在的离子组是( )
A. Na+、NO3-、Cl-、Cu2+ B. Na+、K+、Ba2+、HCO3-
C. Mg2 +、K+、SO32-、Cl- D. Na+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,利用下图装置用正丁醇合成正丁醛。相关数据如下:
,利用下图装置用正丁醇合成正丁醛。相关数据如下:

物质 | 沸点/℃ | 密度/(g· | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,正确的是 ( )
A. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
B. 当温度计1示数为90~95℃,温度计2示数在117.2℃左右时,收集产物
C. 反应结束,将馏出物倒入分液漏斗中以分去水层,粗正丁醛从分液漏斗上口倒出
D. 为加快反应,应将酸化的Na2Cr2O7溶液一次性全部加入正丁醇中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法正确的是
A. 生石灰用作食品抗氧化剂
B. 氢氟酸能与SiO2反应,故可用氢氟酸在玻璃上蚀刻标记
C. 铝罐可久盛咸的食物
D. 苏打是面包发酵粉的主要成分之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com