
 2G��g��������
2G��g��������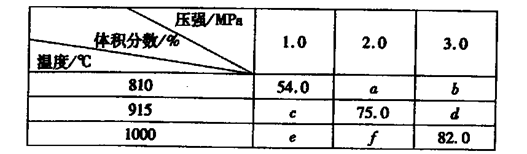
 HCO3��+H+�ĵ��볣��Ka=4��10��7 mo1��L��1������¶��£�NaHCO3��ˮ�ⳣ��Kh= �������ʵ����Թ�ʵ��֤��Na2CO3��Һ�д���CO32��+H2O
HCO3��+H+�ĵ��볣��Ka=4��10��7 mo1��L��1������¶��£�NaHCO3��ˮ�ⳣ��Kh= �������ʵ����Թ�ʵ��֤��Na2CO3��Һ�д���CO32��+H2O  HCO3��+OH������ʵ ��
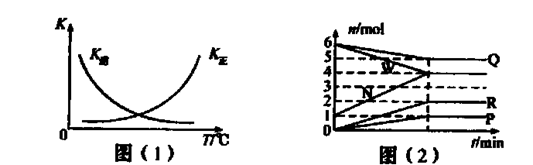
HCO3��+OH������ʵ �� 2G��g������Ϊ���������С�ķ�Ӧ����ѹ��ƽ�������ƶ���G�����������%����С�����������ݷ���������Ϊѹǿ��ƽ��Ӱ������ݣ���54.0��a��b��c��75.0��d��e��f��82.0���ɵ�a��b��f���ߵĴ�С��ϵΪf��a��b��������������֪��e��c��54.0,������������Ϊ�¶ȶ�ƽ���Ӱ�죬���£�G�����������%������ƽ�������ƶ�����÷�Ӧ����Ϊ���ȷ�Ӧ����K��915�棩��K��810�棩�Ĺ�ϵΪK��915�棩����K��810�棩�������������֪��1000�桢3��0 MPaʱG�����������%��Ϊ82.0�����ݷ�Ӧ��E��g��+F��s��
2G��g������Ϊ���������С�ķ�Ӧ����ѹ��ƽ�������ƶ���G�����������%����С�����������ݷ���������Ϊѹǿ��ƽ��Ӱ������ݣ���54.0��a��b��c��75.0��d��e��f��82.0���ɵ�a��b��f���ߵĴ�С��ϵΪf��a��b��������������֪��e��c��54.0,������������Ϊ�¶ȶ�ƽ���Ӱ�죬���£�G�����������%������ƽ�������ƶ�����÷�Ӧ����Ϊ���ȷ�Ӧ����K��915�棩��K��810�棩�Ĺ�ϵΪK��915�棩����K��810�棩�������������֪��1000�桢3��0 MPaʱG�����������%��Ϊ82.0�����ݷ�Ӧ��E��g��+F��s�� 2G��g����������ʽ���㣬����ʼ�����E���ʵ���Ϊ1mol��ת����Ϊx��
2G��g����������ʽ���㣬����ʼ�����E���ʵ���Ϊ1mol��ת����Ϊx�� 2G��g��
2G��g�� CO32��+H2O HCO3��+OH������ʵΪȡ����̼������Һ�����Թ��У��μ��Ȼ�����Һ�а�ɫ�������ɣ�֤������̼�������ȡ����̼������Һ�����Թ��У��μӷ�̪��Һ��죬֤�������������ɡ�
CO32��+H2O HCO3��+OH������ʵΪȡ����̼������Һ�����Թ��У��μ��Ȼ�����Һ�а�ɫ�������ɣ�֤������̼�������ȡ����̼������Һ�����Թ��У��μӷ�̪��Һ��죬֤�������������ɡ�

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=4�Ĵ����У�c(H+)=4.0mol?L��1 |
| B������С�մ���Һ�У�c(Na+)= c(HCO3��) |
| C������ʳ��ˮ�У�c(Na+)+ c(H+)= c(Cl��)+c(OH��) |
| D��pH=12�Ĵ�����Һ�У�c(OH��)=1.0��10��2mol?L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��b��c������Һ�ĵ���������ͬ |
B��c����Һ�� |
| C��a��b��c������Һ��ˮ�ĵ���̶�a>c>b |
D������ͬŨ�ȵ�����ֱ���������b��c����Һ��Ӧ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | CH3COOH | HCN | H2CO3 |
| K | 1.8��10��5 | 4.9��10��10 | K1=4.3��10��7 K2=5.6��10��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH��9��NH4Cl��NH3?H2O�����Һ��c(Cl-)>c ) |
| B��pH��2��5�Ŀ�����c(H��) ��pH��3��5������ˮ��c(H��)��10�� |
| C��AgCl��0��1mol /L CaCl2��Һ��0��1mol/L NaCl��Һ�е��ܽ����ͬ |
| D��1 mL 1mol /L Na2CO3��Һ��ˮϡ����100mL�� pH��Kw����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ����pH��3��CH3COOH��pH��11��NaOH��Һ�������϶��� |
| B������Һ�ɵ����ʵ���Ũ�ȡ��������NaOH��Һ��CH3COOH��Һ��϶��� |
| C������������NaOH����Һ������Ũ��Ϊc(CH3COO��)��c(Na��)��c(OH��)��c(H��) |
D������������ˮ��c(CH3COO��)һ������c(Na��)��c(NH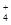 )֮�� )֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����Һ??��ʱ���صμ���������NaOH����Һ������Ũ�ȿ���Ϊc(CH3COO��)��c(Na��)��c(OH��)��c(H��) |
| B��C��ʱ��pH��5.6������ǡ��Ϊ�����ʵ���CH3COONa��CH3COOH������Һ����Ũ�ȹ�ϵΪ��c(Na��)��c(CH3COO��) |
| C����B�㣬a��20������c(Na��)��c(CH3COO��)��c(OH��)��c(H��) |
| D����D�㣺c(CH3COOH)��c(OH��)��c(H��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a=b | B��a��b |
| C��c(A-)=c(Na+) | D��c(A-)��c(Na+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| ʵ����� | 1 | 2 | 3 | 4 |
| ����NaOH��Һ�����(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| ������ҺŨ��(mol��L��1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com