
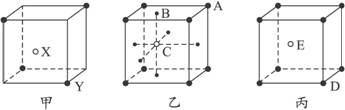
图3-6
试写出:
(1)甲晶体化学式(X为阳离子)为___________________。
(2)乙晶体中A、B、C三种微粒的个数比是______________。
(3)丙晶体中每个D周围结合E的个数是_______________个。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
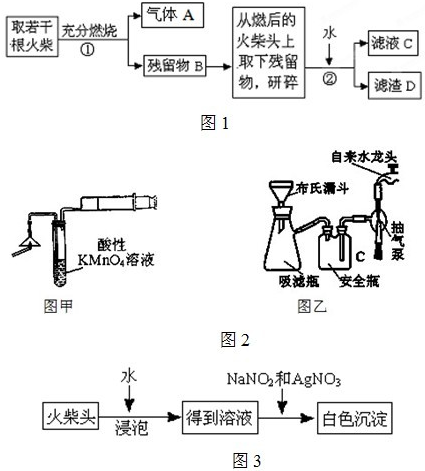
| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
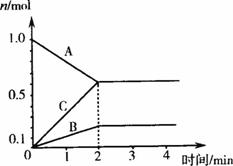
图2-6
(1)由图中的数据分析,该反应的化学方程式为______________________。反应开始至2min,C的平均反应速率为__________________。
(2)如果该反应的逆反应是用于工业上制某种物质的,写出该反应的逆反应·所选择的反应温度:___________,压强:___________。
(3)已知B+C![]() A中AH<0,现分别把2molB和6molC在相同温度和相同容积下,通入甲、乙两容器中,如图2-7所示,甲、乙均为易传热容器,乙是气球,请回答:
A中AH<0,现分别把2molB和6molC在相同温度和相同容积下,通入甲、乙两容器中,如图2-7所示,甲、乙均为易传热容器,乙是气球,请回答:

图2-7
①当反应达到平衡后,两容器内压强P甲__________________P乙。两容器内SO3的物质的量n甲_________n乙(填“>”或“<”或“=”)。
②达到平衡后打开K,乙(气球)的体积将如何变化?_________理由是:____________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:将硫酸亚铁晶体(FeSO4?7H2O)加入如图1中所示的干燥试管A里,隔绝空气加强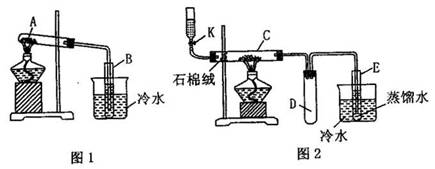
充分反应后,试管A中得残留固体甲,在试管B内得到无色液体乙。取出甲放在图2中的石英管C中,连接好其他部分的仪器后,开启旋塞K,逐滴滴加乙醇使C左部石棉绒(一种纤维状硅酸盐材料,很稳定,不燃烧)浸润吸足,关闭K,然后加热,几分钟左右(加热过程中还可以较快地开启、关闭旋塞K来补充乙醇并使之通入石棉绒里),可观察到甲的颜色由红棕色逐渐变为黑色。反应停止后,取试管E中的液体0.5ml,逐滴加入到含新配制的银氨溶液的试管F中,振荡后,把试管放在水浴中温热,不久会观看到试管内壁上附着一层光亮如镜的金属银。
回答下列问题:
(1)写出如图1所示的干燥试管A中发生反应的化学方程式:_____________________________。
(2)根据反应原理请你评价图1实验装置的主要缺点_____________________________________。
(3)试管C中反应的化学方程式为:________________________________________。
(4)简述如何检验图2所示装置气密性:__________________________________。
(5)试管D安装在此的作用是:_______________________________________。
(6)写出E试管中反应的化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com