
| A. | Al3+、Na+、SO42-、Cl- | B. | Na+、K+、CO32-、SO42- | ||
| C. | K+、NH4+、Cl-、NO3- | D. | Na+、Ba2+、Cl-、NO3- |
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次增强 | B. | HF、HCl、H2S的稳定性依次增强 | ||
| C. | H、Li、Na的原子半径依次增大 | D. | KOH、Mg(OH)2、Al(OH)3的碱依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 定容时,如果加水超过了刻度线,可用蒸发皿蒸出少量水后重新定容 | |
| C. | 配制稀硫酸时,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸 | |
| D. | 称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,砝码放在右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
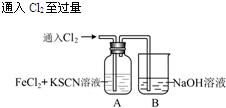 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
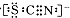
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 65℃ | ---- | --- | 1mL | 100s |
| 2 | 65℃ | 10滴 | --- | 1mL | 90s |
| 3 | 75℃ | 10滴 | ---- | 1mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.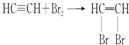
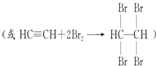 .
.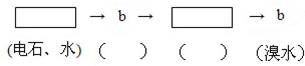
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com