
【题目】如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成,据此判断,下列说法正确的是

A.上述反应不能说明钠比铜活泼
B.上述反应过程中只有一个氧化还原反应发生
C.加热且无水条件下,Na可以与CuSO4反应并生成Cu
D.依据上述反应可说明钠可以从任意铜盐溶液中置换出铜
【答案】C
【解析】
在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成,说明熔融的钠将硫酸铜中的铜置换出来并且放出热量,属于置换反应,钠作还原剂,硫酸铜作氧化剂,说明钠比铜活泼,在无水条件下,Na可以与CuSO4反应并生成Cu,
A.根据以上分析,说明钠比铜活泼,故A错误;
B.上述反应过程中有钠与氧气的反应,还有Na可以与CuSO4反应并生成Cu的反应,都是氧化还原反应,故B错误;
C.钠比铜活泼,在无水条件下,Na可以与CuSO4反应并生成Cu,属于置换反应,故C正确;
D.如果钠与CuSO4溶液混合,则钠先与水反应生成氢氧化钠,氢氧化钠再与硫酸铜反应生成氢氧化铜,不会置换出铜单质,故D错误;
答案选C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示, 已知:ICl中氯为-1价,碘为+1价。下列有关说法正确的是
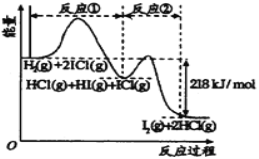
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年5月23日,《南阳日报》发消息称,“水氢发动机”在当地下线,文中称,“车载水可以实时制取氢气,车辆只需加水即可行驶。”文章发布后引发广泛质疑。据报道,该发动机的核心原理是用铝粉与水进行反应得到氢气,作为发动机的燃料。美军曾经报道过“尿氢能”技术,与“水氢汽车”的原理如出一辙,纳米铝粉加尿可得大量氢气,且用尿液与铝粉反应的产氢速率比正常的水高出一倍。下列说法不正确的是( )
A.常温下铝和水的反应不能自发反应,将铝加工为精细铝粉,增大了反应接触面积,使该反应变为自发反应
B.推测尿液与铝粉反应比水快的可能原因是因为尿液呈弱酸性,金属与酸反应速率加快
C.水作为铝的氧化剂的缺点是反应生成的氢氧化铝或氧化铝会吸附在铝表面,阻碍反应进行
D.若需得到标况下体积为10L的氢气,加入的铝粉至少为8.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上主要产钼国家之一,我国的钼资源十分丰富,以辉钼矿为主,是具有优势的战略资源。将辉钼矿精矿(主要成分为MoS2,杂质为CaCO3,SiO2,FeS2,CuFeS2,PbS等)除杂提纯可得到粗MoS2,通过精制转化最终可得到纯度更高的MoS2。
MoS2的相关信息:
①具有类似石墨的层状结构,有金属光泽,熔点1185℃,密度4.80g/cm-3,硬度很低,被广泛地应用在润滑领域。
②一般不溶于水、酸、碱和有机溶剂中,但溶于王水和煮沸的浓硫酸。Mo为+4价,在空气中加热至350℃以上开始被氧化,生成钼的氧化物。
有人提出了如下制取高纯MoS2的流程:
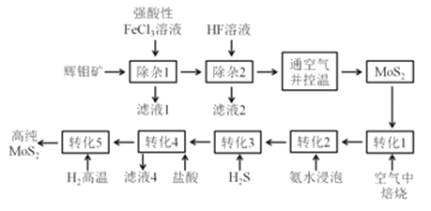
(1) MoS2可用作润滑添加剂的原因是:_____________。
(2)滤液1中存在的阳离子除H+、Ca2+、Pb2+外,还有:____________,写出“除杂1”过程发生的其中1个氧化还原反应的化学方程式:____________。
(3)“通空气并控温”这步操作的目的是:___________。必须控制好温度的原因:___________。
(4)“转化3”得到硫代钼酸铵(NH4)2MoS4。“转化4”中钼的化合价不变,产生气体和沉淀(二元化合物),写出该反应的离子方程式:____。
(5)上述流程中,哪些步骤发生了氧化还原反应:_____。
A.除杂1 B.除杂2 C.转化1 D.转化2 E.转化3 F.转化4 G.转化5
(6)上述流程中,可以循环使用的物质为(写化学式):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰晶体(![]() )是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为
)是重要的微量元素肥料之一。某兴趣小组在实验室中探究用软锰矿(主要成分为![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 等杂质制取硫酸锰晶体,其具体流程如下:
等杂质制取硫酸锰晶体,其具体流程如下:

已知:①反应原理为:![]() ;
;
②![]() 难溶于水。
难溶于水。
(1)滤渣2主要成分是![]() ,步骤②中的稀硫酸的作用是________。
,步骤②中的稀硫酸的作用是________。
(2)步骤③中采用![]() 硫酸和草酸晶体溶解
硫酸和草酸晶体溶解![]() ,草酸晶体的作用是________;配制
,草酸晶体的作用是________;配制![]() 硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
硫酸时,需要的仪器除量筒、烧杯、玻璃棒外,还需要________。将滤渣2置于烧杯中,先加入稀硫酸,将溶液稍加热后,在搅拌下缓慢分批加入草酸晶体,直至烧杯中的固体全部溶解。在搅拌下缓慢分批加入草酸晶体的理由是________。
(3)步骤④的具体实验操作有________,经洗涤后干燥得到![]() 晶体。
晶体。
(4)兴趣小组同学拟继续研究硫酸锰的高温分解的固体产物,经查资料可知:硫酸锰晶体高温下分解产物为![]() 、
、![]() 、
、![]() ,及水蒸气。为了确定
,及水蒸气。为了确定![]() 的化学式,采用下面装置进行测定(已知:
的化学式,采用下面装置进行测定(已知:![]() 的熔点为16.8℃,沸点为44.8℃)。
的熔点为16.8℃,沸点为44.8℃)。

①![]() 装置中吸收的气体为________。
装置中吸收的气体为________。
②实验自始至终均需通入![]() ,其目的是________。
,其目的是________。
③若起始时,在装置A中加入![]() ,充分反应后,测得装置C增重6.4g,则
,充分反应后,测得装置C增重6.4g,则![]() 的化学式为________。
的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
B.向Al2(SO4)3溶液中加入少量氨水:![]()
C.向明矾溶液中加入过量的氢氧化钡溶液:![]()
D.向小苏打溶液中加少量澄清石灰水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3和Cu2O是红色粉末,常作颜料。某校化学实验小组通过实验来探究红色粉末的成分是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是____;若假设2成立,发生反应的离子方程式为______。
(2)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,设计实验计算二者的物质的量:取一定量的该固体粉末溶于500 mL未知浓度的稀硫酸溶液中,固体全部溶解,向反应后的溶液中加入Fe粉,溶液中部分离子的物质的量随Fe粉加入,变化如图所示,则Fe2O3和Cu2O的物质的量分别为____、 _______。

(3)硫酸溶液的物质的量浓度是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g) ![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达到平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达到平衡(Ⅰ)时,X的转化率为5/11
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com