
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.碱性溶液中:K+、HCO3-、Cl-、SO42-
B.酸性溶液中:Na+、Fe3+、NO3-、SO42-
C.含有0.1mol/LCa2+的溶液中:Na+、K+、CO32-、Cl-
D.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Ag+、K+、NO3﹣、Cl﹣ B. Ca2+、Fe3+、Cl﹣、NO3﹣
C. Mg2+、Na+、Cl﹣、SO42﹣ D. H+、NH4+、Na+、CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
![]()
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差3
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A. 11 g D![]() O所含的电子数为5NA
O所含的电子数为5NA
B. 常温下,5.6 g铁与浓硝酸反应转移的电子数为0.3NA
C. 甲烷燃料电池正极消耗标况下11.2L O2时,电路中通过的电子数为2NA
D. 3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量为92 kJ时,转移电子数为6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量为92 kJ时,转移电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质长期露置于空气中会变质,且变质过程中涉及氧化还原反应的是
①Na ②NaOH ③FeSO4 ④氯水
A.①②B.②③C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强或升高温度,一定能使化学反应速率加快
B. 已知Ni(CO)4(g)=Ni(s)+4CO(g) ΔH=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g) ΔH=-Q kJ/mol
C. 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-2Q kJ/mol
2NH3(g) ΔH=-2Q kJ/mol
D. 已知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2 (g),2CO(g)+O2(g)
2Ni(s)+O2 (g),2CO(g)+O2(g) ![]() 2CO2(g)的平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)的平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。
已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。将烟气通入 (NH4)2SO3溶液可以继续吸收SO2 ,用离子方程式表示出能吸收二氧化硫的原因_________。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
A.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_______________________________________。
②一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图1所示:
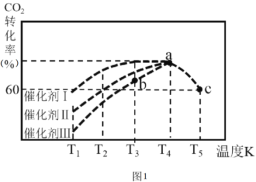
催化剂效果最佳的是催化剂 ______ (填“I”,“Ⅱ”,“Ⅲ”)。b点v(正)___v(逆) (填“>” ,“< ”,“=”)。此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_______。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=________。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
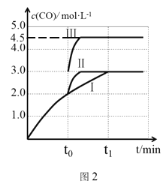
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com