
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
(1)①钢铁在海水中容易发生电化学腐蚀,正极反应式是__________。
②图中,为减缓钢闸门的腐蚀,材料B可以选择__________(填“Zn”或“Cu”)。
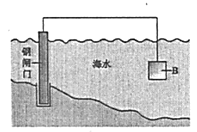
(2)如图为钢铁防护模拟实验装置,则铁做__________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,_________,则说明保护效果好。

(3)氢氧燃料电池是一种新型的化学电源,其构造如图所示:

a、b为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①a的电极反应式是_________;
②若电池共产生3.6g水,则电路中通过了_______mol的电子。
【答案】O2+4e-+2H2O=4OH- Zn 阴 滴加铁氰化钾(K3Fe(CN)6)溶液,若无蓝色沉淀产生 H2-2e-+2OH-=2H2O 0.4
【解析】
(1)①钢铁在海水中发生电化学腐蚀的正极反应取决于电化学腐蚀的类型,按类型书写即可;
②由图判断防护方法是原电池原理,据此可以选择材料B;
(2)图知钢铁防护的方法是电解方法,则可判断铁是阴极;检测钢铁保护效果的方法是:检测铁电极附近的溶液中的亚铁离子浓度;
(3)①通过通入电极a的反应物是氢气,判断电极是负极,书写电极反应式;
②按电池反应方程式,结合已知条件:电池共产生3.6g水,即可计算电路中通过电子的物质的量。
(1)①钢铁在海水中发生吸氧腐蚀,则正极反应式为:O2+4e-+2H2O=4OH-;
答案为:O2+4e-+2H2O=4OH-;
②由图判断防护方法是原电池原理,要保护铁,铁作原电池的正极,那么负极就选比铁活泼的金属锌;
答案为:Zn;
(2)图知钢铁防护的方法是电解方法,是外接电源的阴极保护法,则铁是阴极;检测钢铁保护效果的方法是:检测铁电极附近的溶液中的亚铁离子浓度,浓度越低保护效果就越好,因此可取铁电极附近的溶液少量,滴加铁氰化钾(K3Fe(CN)6)溶液,若无蓝色沉淀产生,则保护效果好;
答案为:阴;滴加铁氰化钾(K3Fe(CN)6)溶液,若无蓝色沉淀产生;
(3)氢氧燃料电池是一种新型的化学电源,
①通入电极a的反应物是氢气,则电极a是负极,氢气在负极发生氧化反应,因为电解质是碱溶液,则其电极反应式为H2-2e-+2OH-=2H2O;
答案为:H2-2e-+2OH-=2H2O
②按电池反应方程式![]() ,则
,则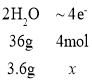 ,得x=0.4mol;
,得x=0.4mol;
答案为:0.4。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】用块状碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
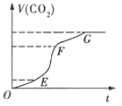
(1)实验过程如图所示,分析判断:(填“OE”、“EF”或“FG”,下同)___段化学反应速率最大,___段收集的二氧化碳气体最多。
(2)ag块状碳酸钙与足量盐酸反应,碳酸钙消耗的质量随时间的变化曲线用实线表示,在相同的条件下,将bg(a>b)粉末状碳酸钙与足量的相同浓度的盐酸反应,碳酸钙消耗的质量随时间的变化曲线用虚线表示。则图中最符合实际情况的图象是___(填序号)。
A.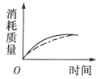 B.
B.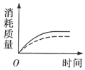 C.
C. D.
D.
(3)为了减缓题述反应的速率,下列措施中,你认为可行的是___(填序号)
A.加入蒸馏水
B.加入氯化钠固体
C.加入硝酸钾溶液
D.加入浓盐酸
E.降温
F.加入MnO2粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。

已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=﹣lgY.下列叙述不正确的是( )
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p![]() 的变化关系
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)石墨电极(C)作___极,丙池中滴有酚酞,实验开始后观察到的现象是_____,甲中甲烷燃料电池的负极反应式为________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为___ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______。
A.b电极为粗铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________。
(5)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将_______,(填“增大”“减小”或“不变”),且变化了_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(夹持已装置省略)进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀硫酸 | Na2CO3 | CaCl2溶液 | CO2可与氯化钙反应 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是()
2C(g)达到平衡的标志的是()
(1)C的生成速率与C的分解速率相等;
(2)单位时间内生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5)B.(1)(3)C.(2)(7)D.(5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下某水溶液中的![]() 、
、![]() 浓度变化曲线如图所示,下列说法不正确的是
浓度变化曲线如图所示,下列说法不正确的是
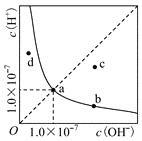
A.向蒸馏水中加入NaOH固体充分溶解后恢复至室温,溶液最终可能落在b点
B.![]() 与HCl的混合溶液中水电离出的
与HCl的混合溶液中水电离出的![]() 浓度可能等于d点坐标
浓度可能等于d点坐标
C.若b点表示盐NaR的水溶液,向其中逐滴滴入过量的HR溶液,会引起b向c的变化
D.若c点表示某温度下盐NaHA的水溶液,则![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com