
【题目】NaNO2是一种白色易溶于水的固体,溶液呈碱性,其外观与氯化钠相似,有咸味,俗称工业盐;是一 种重要的化学试剂、漂白剂和食品添加剂。已知亚硝酸盐能被溴水氧化,在酸性条件下能氧化亚铁离子; 亚硝酸银是可溶于稀硝酸的白色沉淀。
请完成以下填空:
(1)N原子最外层电子的轨道排布式为_______;用一个事实说明氮和氧非金属强弱_______。
(2)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出此反应①的离子方程式并标出电子转移的方向和数目______。
(3)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,工业上氧化卤水中的I-提取单质I2选择了价格并不便宜的亚硝酸钠,可能的原因是_______。
(4)在盐酸溶液中加入亚硝酸钠溶液至中性,则c(Cl-)_____c(HNO2)(填“<”、“>”或“=”)。
(5)设计一种鉴别亚硝酸钠和氯化钠的实验方案。_______
【答案】![]() 氢化物稳定性:H2O>NH3,氧强于氮
氢化物稳定性:H2O>NH3,氧强于氮 ![]() 氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2 = 取样溶于水,分别测定它们的pH值, 一种pH值大于7,一种pH值等于7, pH值大于7的为亚硝酸钠,pH值等于7的为氯化钠
氯气、浓硝酸、酸性高锰酸钾氧化性太强,还能继续氧化I2 = 取样溶于水,分别测定它们的pH值, 一种pH值大于7,一种pH值等于7, pH值大于7的为亚硝酸钠,pH值等于7的为氯化钠
【解析】
(1)氮原子最外层有5个电子,先排2s轨道,另外3个排在3个2p轨道里;元素的非金属性越强,形成的气态氢化物就越稳定;
(2)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮、碘和水;
(3)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(4)根据亚硝酸钠溶液中水解平衡和酸碱中和解答;
(5)根据亚硝酸钠和氯化钠的不同性质来进行区分。
(1)氮原子最外层有5个电子,先排2s轨道,另外3个排在3个2p轨道里,氮原子最外层电子排布轨道表示式为:![]() ;元素的非金属性越强,形成的气态氢化物就越稳定,氢化物稳定性:H2O>NH3,非金属性氧强于氮;
;元素的非金属性越强,形成的气态氢化物就越稳定,氢化物稳定性:H2O>NH3,非金属性氧强于氮;
(2)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮、碘和水,离子反应方程式为:2I-+2NO2-+4H+=I2+2NO+2H2O,电子转移的方向和数目为:![]() ;
;
(3)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠;故答案为:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(4)亚硝酸钠溶液中发生水解反应NO2-+H2O![]() HNO2+OH-而呈碱性,在盐酸溶液中加入亚硝酸钠溶液至中性说明亚硝酸钠水解产生的氢氧根等于盐酸溶液中的氢离子,即c(OH-)= c(H+),又因为c (OH-)= c(HNO2),盐酸溶液中c (H+)= c(Cl-),所以c(Cl-)=c(HNO2);
HNO2+OH-而呈碱性,在盐酸溶液中加入亚硝酸钠溶液至中性说明亚硝酸钠水解产生的氢氧根等于盐酸溶液中的氢离子,即c(OH-)= c(H+),又因为c (OH-)= c(HNO2),盐酸溶液中c (H+)= c(Cl-),所以c(Cl-)=c(HNO2);
(5)根据亚硝酸钠和氯化钠的不同性质来进行区分,根据所给的信息及我们所学的氯化钠的性质可以知道:亚硝酸钠是强碱弱酸盐,其溶液呈碱性,而氯化钠溶液时中性,所以可以取样溶于水,分别测定它们的pH值, 一种pH值大于7,一种pH值等于7, pH值大于7的为亚硝酸钠,pH值等于7的为氯化钠。


科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g) = CO2(g)+3H2(g) △H = + 49. 0 kJ·mol-1②CH3OH(g)+ ![]() O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
O2(g) = CO2(g)+2H2(g) △H =-192. 9 kJ·mol-1,下列说法正确的是
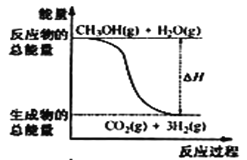
A.CH3OH的燃烧热为192. 9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l) +![]() O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
O2(g) = CO2(g) +2H2(g) △H >-192. 9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应A(g)2B(g)△H,若正反应的活化能为EakJ·mol-l,逆反应的活化能为EbkJ·mol-l,则△H=-(Ea-Eb)kJ·mol-l
B.某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C.将0.2mol·L-1的CH3COOH溶液与0.1mol·L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.将浓度为0.1mol·L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示:
2SO3(g),反应过程的能量变化如图所示:
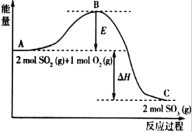
已知2mol SO2(g)和O2(g)反应生成为1mol SO3(g)的ΔΗ=-99kJ·mol-1,请回答下列问题。
(1)该反应通常用V2O5作催化剂,加V2O5会使图中B点_______ (填“升高”或“降低”)。
(2)图中ΔΗ= __________。
(3)如果反应速率v(SO2)为0.05mol·L-1·min-1,则v(O2)= _______。
Ⅱ.已知下列热化学方程式:
①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是___________;
(2)燃烧10 g H2生成液态水,放出的热量为__________;
(3)写出CO燃烧的热化学方程式__________;
(4)写出制水煤气的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列说法正确的是( )
A.向氨水中加入氯化铵固体,会使溶液的pH增大
B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大
C.常温下,浓度均为0.1mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
D.NaHCO3饱和水溶液中c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验一批因露置而部分变质的Ba(OH)2药品的成分,某化学探究性学习小组设计了方案对其进行将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。

(1) 写出硫酸工业尾气与过量的Ba(OH)2反应的离子方程式:________________________
(2)提出以下三种合理假设:(已知在空气中Ba(OH)2很难生成酸式盐)
假设一:药品成分为Ba(OH)2和BaSO4、BaSO3;
假设二:药品成分为Ba(OH)2和________________;
假设三:药品成分为Ba(OH)2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立; |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤
步骤2:甲同学取一定量固体,用气密性良好的右图装置(夹持仪器未画出)进行定性实验。

请回答下列问题:
(1)假设2中的沉淀为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的____ __。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设______(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是廉价的碳资源,其综合利用具有重要意义。
(1)CO2与CH4经催化重整反应CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+120kJ·mol-1可以制得合成气。
已知上述反应中相关物质所含化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | a | b | c | x |
①x=___。
②分别在恒温密闭容器A(恒容)、B(恒压,体积可变)中,加入CH4和CO2各1mol的混合气体,起始体积均为VL。相同温度下两容器中反应达平衡后吸收热量较多的是___ (填“A”或“B”)。保持A容器的体积和B容器压强不变,写出一种能使A、B两容器中各物质的体积分数相同的方法:___。
③某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行反应,达到平衡时CO2的体积分数为![]() ,该温度下反应的平衡常数为___。
,该温度下反应的平衡常数为___。
(2)CO2可以被NaOH捕获。所得溶液中含碳微粒的分布百分数随pH的变化如图所示。H2CO3的二级电离平衡常数Ka2=___。pH=5.4时,φ(A):φ(B)=___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,一定不存在同分异构体的是
A.异戊二烯与等物质的量的Br2反应
B.邻羟基苯甲酸与NaHCO3溶液反应
C.甲苯与Cl2在一定条件下发生取代反应
D.2-氯丁烷与NaOH乙醇溶液共热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com