
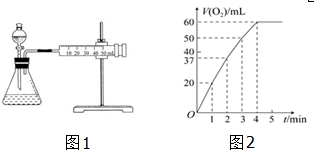
分析 (1)实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(2)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减慢;
(3)A.化学反应速率,表示反应快慢物理量,可以指导在一定时间内快出产品;
B.勒夏特列原理即平衡移动原理可指导怎样使用有限原料多出产品;
C.催化剂的使用只能提高反应速率;
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
解答 解:(1)通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较,
故答案为:单位时间生成O2的体积或生成单位体积O2所需要的时间;
(2)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;
故答案为:随着反应的进行,浓度减小,反应速率减慢;
(3)A.化学反应速率,表示反应快慢物理量,故A正确;
B.勒夏特列原理是平衡移动原理,可指导怎样使用有限原料多出产品,故B正确;
C.催化剂的使用提高反应速率,不能改变产量,只能缩短到达平衡时间,故C错误;
D.综合经济效益既考虑原料的利用率又要考虑时间,故D正确;
故答案为:C.
点评 本题考查了化学反应速率的影响因素以及化学平衡移动原理,明确影响化学反应速率的因素以及化学平衡移动原理为解答关键,注意催化剂只能加快化学反应速率,不能改变化学反应的限度.


科目:高中化学 来源: 题型:解答题
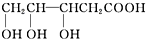
| A的性质 | 推断A的组成、结构 |
| ①能燃烧,燃烧产物只有CO2和H2O | 一定含有C、H元素,可能含有O元素 |
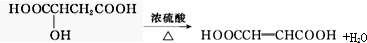
| ②A与醇或羧酸在浓硫酸存在下均能生成有香味的物质 | A分子中含有-OH、-COOH |
| ③在一定条件下,A能发生分子内脱水反应,其生成物与溴水混合,溴水褪色 | - |
| ④0.1mol A与足量NaHCO3溶液反应产生4.48L(标准状况下)气体 | A分子中含有两个-COOH |
 .
.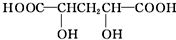
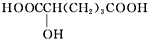
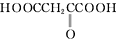
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、Mg2+、AlO${\;}_{2}^{-}$、NO${\;}_{3}^{-}$可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 通入H2S气体无明显现象,原因是二者不反应 | |
| D. | 与少量Ba(OH)2溶液反应的离子方程式:Al3++2SO${\;}_{4}^{2-}$+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
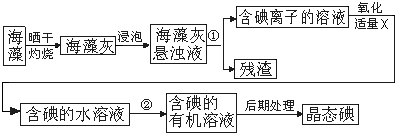
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
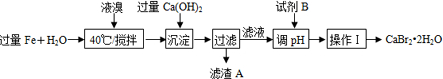
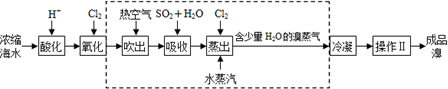
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
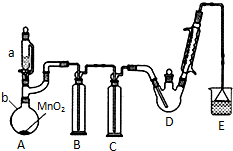 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和M原子的最外层电子数之差不一定为5 | |
| B. | A和M原子的最外层电子数之和一定为7 | |
| C. | A和M原子的电子数之差一定为11 | |
| D. | A和M的原子序数之差不一定为5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com